题目内容
 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图所示;两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.(1)a极是
负
负
极,b极是正
正
极,电极反应式分别为2H2+4OH--4e-=4H2O
2H2+4OH--4e-=4H2O
,O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.(2)氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制.常用的燃料,往往是某些碳氢化合物,如甲烷(天然气)、汽油等.请写出将图中H2换成CH4时所构成的甲烷燃料电池中a极的电极反应式:
CH4+10OH-+8e-=CO32-+7H2O
CH4+10OH-+8e-=CO32-+7H2O
.此时电池内总的反应方程式为CH4+2O2+2OH-=CO32-+3H2O
CH4+2O2+2OH-=CO32-+3H2O
.分析:(1)氢氧燃料电池中,原电池工作时,氢氧燃料电池的总反应为2H2+O2=2H2O;通入氢气的一极a为电源的负极,发生氧化反应,电极反应式为:H2-2e-+2OH-=2H2O,通入氧气的一极b为原电池的正极,
电极反应式为:O2+4e-+2H2O=4OH-;
(2)氢气换成甲烷是甲烷和氧气反应生成二氧化碳和水的氧化还原反应,图中电解质溶液是碱性溶液,依据原电池的原理,结合元素化合价变化分析失电子的物质甲烷在负极a发生氧化反应,氧气再正极b发生还原反应;
电极反应式为:O2+4e-+2H2O=4OH-;
(2)氢气换成甲烷是甲烷和氧气反应生成二氧化碳和水的氧化还原反应,图中电解质溶液是碱性溶液,依据原电池的原理,结合元素化合价变化分析失电子的物质甲烷在负极a发生氧化反应,氧气再正极b发生还原反应;
解答:解:(1)氢氧燃料电池中,通入氢气的一极为电源的负极,通入氧气的一极为原电池的正极,由于电解质溶液呈碱性,则负极电极反应式为:2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O),正极电极反应式为:O2+4e-+2H2O=4OH-,
故答案为:负;正;2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O);O2+4e-+2H2O=4OH-;
(2)图中H2换成CH4时所构成的甲烷燃料电池中,甲烷燃烧生成二氧化碳和水,二氧化碳和氢氧化钾反应生成碳酸钾和水,所以电池的反应的离子方程式为:CH4+2O2+2OH-=CO32-+3H2O
其中正极上是氧气得到电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-;电池总反应的离子方程式减去正极电极反应×2,得到负极电极反应:CH4+10OH-+8e-=CO32-+7H2O;
故答案为:CH4+10OH-+8e-=CO32-+7H2O、CH4+2O2+2OH-=CO32-+3H2O;
故答案为:负;正;2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O);O2+4e-+2H2O=4OH-;
(2)图中H2换成CH4时所构成的甲烷燃料电池中,甲烷燃烧生成二氧化碳和水,二氧化碳和氢氧化钾反应生成碳酸钾和水,所以电池的反应的离子方程式为:CH4+2O2+2OH-=CO32-+3H2O
其中正极上是氧气得到电子发生还原反应,电极反应式为:O2+2H2O+4e-=4OH-;电池总反应的离子方程式减去正极电极反应×2,得到负极电极反应:CH4+10OH-+8e-=CO32-+7H2O;
故答案为:CH4+10OH-+8e-=CO32-+7H2O、CH4+2O2+2OH-=CO32-+3H2O;
点评:本题考查了原电池的工作原理的应用,电极名称,电极判断,电极反应,电池反应,熟练掌握原电池的基本知识,分清化合价变化判断氧化反应、还原反应、电子守恒是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其构造如图所示:a、b两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电.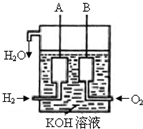 已知在25°C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题:
已知在25°C、1.013×105Pa下,1mol氢气完全燃烧生成液态水放出285kJ的热量,请回答下列问题: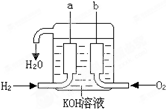 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,被称为21世纪的明星电池,其构造如图所示:两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,被称为21世纪的明星电池,其构造如图所示:两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电.