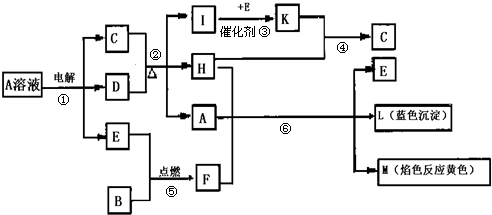
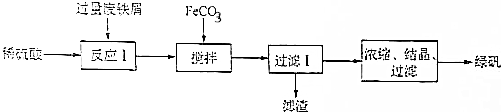
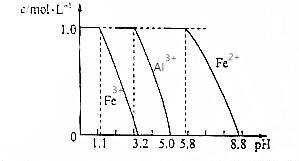
题目内容
14.下列关于热化学反应的描述中正确的是( )| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g) △H=-192.9 kJ•mol-1,则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 | |
| D. | 葡萄糖燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1 |
分析 A、硫酸和氢氧化钡溶液中和反应生成硫酸钡沉淀,存在沉淀热;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,应是燃烧生成二氧化碳和液体水;
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式改变方向,焓变符号随之改变;
D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量;
解答 解:A、硫酸和氢氧化钡溶液中和反应生成硫酸钡沉淀,存在沉淀热,则H2SO4和Ba(OH)2的反应热△H<2×(-57.3)kJ•mol-1,故A错误;
B、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,应是燃烧生成二氧化碳和液体水放出的热量,选项中生成物不是稳定氧化物,故B错误;
C、燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,热化学方程式改变方向,焓变符号随之改变,水是气体,不符合燃烧热概念,故C错误;
D、葡萄糖燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1,符合燃烧热概念,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,故D正确;
故选D.
点评 本题考查了燃烧热概念的理解应用,主要是热化学方程式书写方法和正误判断,注意关闭反应方向,焓变符号随之改变,题目难度中等.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
4.下列现象因发生物理变化引起的是( )
| A. | 活性炭使蓝色墨水褪色 | |
| B. | 盛石灰水的试剂瓶久置后内壁出现白色固体 | |
| C. | 蛋白质灼烧时发出烧焦羽毛的气味 | |
| D. | 湿润红布条置于氯气的集气瓶中,红布条褪色 |
5.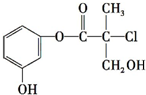 现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
 现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )
现有结构简式如图所示的某有机物,它是药物生产的中间体,关于该有机物叙述正确的是( )| A. | 该有机物与溴水发生加成反应 | |
| B. | 该有机物与浓硫酸混合加热可发生消去反应 | |
| C. | 该有机物经催化氧化后能发生银镜反应 | |
| D. | 1mol该有机物与足量NaOH溶液反应最多消耗3molNaOH |
2.下列说法正确的是( )
| A. | 盐类发生水解的过程中,溶液的pH一定发生改变 | |
| B. | 向K2CO3溶液中通入CO2可使溶液中的c(CO32-)变大 | |
| C. | 向Na2SO3溶液中通入Cl2,溶液的导电性变强 | |
| D. | 一定温度下的密闭容器中,反应2NO2?N2O4达平衡时,再加入1molN2O4,平衡正向移动,且N2O4含量增大 |
19.下列各组离子,能在指定溶液中一定能大量共存的是( )
| A. | 含有大量Fe3+的溶液:Na+、SCN-、Cl-、I- | |
| B. | 中性溶液:Fe3+、Al3+、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$ | |
| C. | 常温下,pH=12的溶液:Na+、K+、Cl-、SO${\;}_{4}^{2-}$ | |
| D. | 与铝粉反应放出H2的无色溶液:Br-、Al3+、Na+、SO${\;}_{4}^{2-}$ |
3.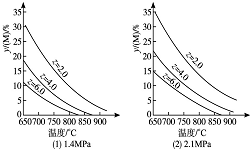 反应aM(g)+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法不正确的是( )
反应aM(g)+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法不正确的是( )
 反应aM(g)+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法不正确的是( )
反应aM(g)+bN(g)?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法不正确的是( )| A. | 同温同压同z时,加入催化剂,平衡时Q的体积分数不改变 | |
| B. | 同温同压时,增加z,平衡时Q的体积分数一定增加 | |
| C. | 同温同z时,增加压强,平衡时Q的体积分数一定减小 | |
| D. | 同压同z时,升高温度,平衡时Q的体积分数一定增加 |
 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为: