题目内容
【题目】根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料。完成下列填空:
(1)将0.050mol SO2(g) 和0.030mol O2(g) 充入一个2L的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)2SO3(g)+Q。经2分钟反应达到平衡,测得n(SO3)=0.040mol,则O2的平均反应速率为______
(2)在容积不变时,下列措施中有利于提高SO2平衡转化率的有______(选填编号)
a.移出氧气 b.降低温度
c.减小压强 d.再充入0.050molSO2(g)和0.030molO2(g)
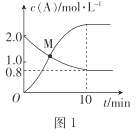
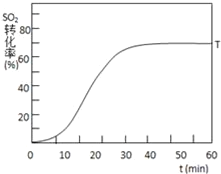
(3)在起始温度T1(673K)时SO2的转化率随反应时间(t)的变化如图,请在图中画出其他条件不变情况下,起始温度为T2(723K)时SO2的转化率随反应时间变化的示意图___
(4)黄铁矿在一定条件下煅烧的产物为SO2和Fe3O4
①将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需维持溶液有足够的酸性,其原因是______
②FeS2能将溶液中的Fe3+还原为Fe2+,本身被氧化为SO42﹣。写出有关的离子方程式______。有2mol氧化产物生成时转移的电子数为______
【答案】0.005mol/(Lmin) bd 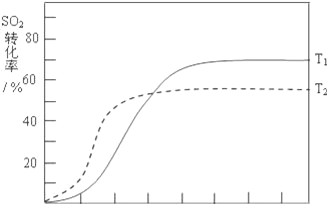 抑制Fe3+与Fe2+的水解,并防止Fe2+被氧化成Fe3+ FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+ 14NA
抑制Fe3+与Fe2+的水解,并防止Fe2+被氧化成Fe3+ FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+ 14NA
【解析】
(1)根据v=![]() 求出氧气的速率,然后根据速率之比等于对应物质的化学计量数之比计算;
求出氧气的速率,然后根据速率之比等于对应物质的化学计量数之比计算;
(2)反应放热,为提高SO2平衡转化率,应使平衡向正反应方向移动,可降低温度,体积不变,不能从压强的角度考虑,催化剂不影响平衡移动,移出氧气,平衡向逆反应方向移动,不利于提高SO2平衡转化率,由此分析解答;
(3)反应是放热反应,温度升高,平衡逆向进行,二氧化硫的转化率减小,但达到平衡所需要的时间缩短,据此画出曲线;
(4)①Fe3+与Fe2+易水解,Fe2+易被氧化成Fe3+;
②根据氧化还原反应中的反应物和生成物几何电子守恒来配平化学方程式,结合方程计算转移电子数。
(1)v(SO3)=![]() =
= =0.01mol/(Lmin),所以v(O2)=
=0.01mol/(Lmin),所以v(O2)=![]() v(SO3)=0.005mol/(Lmin),故答案为:0.005mol/(Lmin);
v(SO3)=0.005mol/(Lmin),故答案为:0.005mol/(Lmin);
(2)a.移出氧气,平衡逆向移动,二氧化硫的转化率减少,故不选;
b.降低温度,平衡正向移动,二氧化硫的转化率增大,故选;
c.减小压强,平衡逆向移动,二氧化硫的转化率减少,故不选;
d.再充入0.050molSO2(g)和0.030molO2(g),相当于增大压强,平衡正向移动,二氧化硫的转化率增大,故选;
故答案为:bd;
(3)反应:2SO2(g)+O2(g)2SO3(g) △H<0,SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如图,其他条件不变,仅改变起始温度为T2=723K,温度升高,平衡逆向进行,二氧化硫的转化率减小,但反应速率增大,达到平衡需要的时间短,在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图如图所示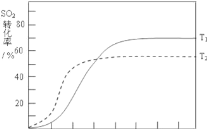 ;故答案为:
;故答案为: ;
;
(4)①Fe2O3(或Fe3O4等)溶于H2SO4后,生成的Fe3+与Fe2+易水解,Fe2+易被氧化成Fe3+,所以要加入Fe粉和酸,抑制Fe3+与Fe2+的水解,并防止Fe2+被氧化成Fe3+,故答案为:抑制Fe3+与Fe2+的水解,并防止Fe2+被氧化成Fe3+;
②2价的硫离子具有还原性,FeS2可以将溶液中的Fe3+还原为Fe2+,而本身被氧化为硫酸根离子,有关的离子方程式为:FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+,氧化产物是硫酸根离子,有2mol硫酸根生成时转移的电子数为14NA,故答案为:FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+;14NA。