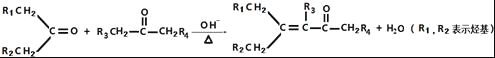
题目内容
【题目】硝酸的工业制备包括氨的合成、氨的催化氧化及硝酸的浓缩等过程.完成下列计算:
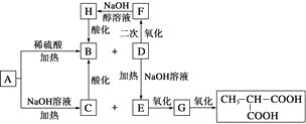
(1)采用甲烷的二次转化法可以制备氢气.
第一次转化的化学方程式:CH4+H2O→CO+3H2;
第二次转化的化学方程式:2CO+CH4+2O2→3CO2+2H2;2CO+O2→2CO2.
现有标准状况下1m3的甲烷,若第一次转化80%,第二次转化20%,经过二次完全转化后可以得到H2__mol.
(2)用饱和K2CO3溶液吸收上述混合气体中的CO2以得到纯净的氢气.处理上述的CO2至少需要饱和K2CO3溶液____g.(已知:20℃K2CO3溶解度:110g/100g水)
(3)已知NH3+2O2→HNO3+H2O.现有氨气1.7吨,不补充水,理论上可制得硝酸的浓度为___%;在该硝酸中加入__吨水最终可得50%的硝酸.
(4)工业上常用98%的浓H2SO4作为制取浓HNO3的脱水剂.63.5%HNO3(质量为M1)中加98%的浓H2SO4(质量为M2)后蒸馏.分别得到97.7%的HNO3和49%的H2SO4溶液(不含HNO3).
①若蒸馏过程中HNO3、H2SO4、H2O均无损耗,求蒸馏前的投料比![]() 的值__(列式计算).
的值__(列式计算).
②蒸馏过程中,若H2O的损耗占总质量的5.0%,即有(M1+M2)×5.0%的H2O流失.则投料时,![]() 比值如何变化,请列式计算说明__.
比值如何变化,请列式计算说明__.
【答案】125 11761 77.78 4.5 ![]() 配料比应增大.
配料比应增大.
【解析】
(1)第一步反应中参加反应甲烷为1m3×80%=0.8m3,根据方程式计算第一步反应生成氢气体积,第二步参加反应甲烷为1m3×20%=0.2m3,根据方程式计算第二步反应生成氢气体积,二者之和为生成氢气总体积,再根据n=![]() 计算;
计算;
(2)根据C元素守恒计算生成二氧化碳的物质的量,再根据K2CO3+CO2=2KHCO3计算需要K2CO3的质量,结合溶解度计算溶液质量;
(3)由方程式可知HNO3、H2O的物质的量之比为1:1,质量之比为63:18,进而计算所得硝酸溶液的质量分数,根据方程式计算生成HNO3、水的质量,可得到硝酸溶液质量,再根据稀释中HNO3质量不变计算稀释后溶液质量,进而计算加入水的质量;
(4)①设蒸馏得到HNO3溶液的质量为xg,蒸馏得到H2SO4溶液的质量为yg,根据溶质质量不变用M1、M2分别表示出x、y,结合M1+M2=x+y进行解答;
②结合①中表达式分析解答,由于H2O流失5%,则此时(x+y)=(M1+M2)×95%。
(1)第一步反应中参加反应甲烷为1m3×80%=0.8m3,由CH4+H2O→CO+3H2可知,第一步反应生成氢气体积为3×0.8m3=2.4m3,第二步参加反应甲烷为1m3×20%=0.2m3,由2CO+CH4+2O2→3CO2+2H2可知,第二步反应生成氢气体积为2×0.2m3=0.4m3,故生成氢气总体积为2.4m3+0.4m3=2.8m3,标况下得到气体物质的量为![]() =125mol;
=125mol;
(2)根据C元素守恒,生成二氧化碳的物质的量为![]() =
=![]() mol,由K2CO3+CO2=2KHCO3可知,需要K2CO3的质量为
mol,由K2CO3+CO2=2KHCO3可知,需要K2CO3的质量为![]() mol×138g/mol,需要饱和K2CO3溶液质量为:
mol×138g/mol,需要饱和K2CO3溶液质量为:![]() mol×138g/mol÷
mol×138g/mol÷![]() =11761g;
=11761g;
(3)由方程式可知HNO3、H2O的物质的量之比为1:1,质量之比为63:18,所得硝酸溶液的质量分数=![]() ×100%=77.78%,
×100%=77.78%,
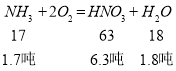
稀释可得50%的硝酸为![]() =12.6吨,故需要加入水的质量为12.6吨﹣6.3吨﹣1.8吨=4.5吨;
=12.6吨,故需要加入水的质量为12.6吨﹣6.3吨﹣1.8吨=4.5吨;
(4)①解:设蒸馏得到HNO3溶液的质量为xg,蒸馏得到H2SO4溶液的质量为yg,则x=![]() ,y=
,y=![]() ,因为M1+M2=x+y,所以
,因为M1+M2=x+y,所以![]() =M1+M2,整理可得
=M1+M2,整理可得![]() =
=![]() ;
;
②所以![]() =(M1+M2)×95%,整理可得
=(M1+M2)×95%,整理可得![]() =
=![]() >
>![]() ,配料比应增大。
,配料比应增大。