题目内容
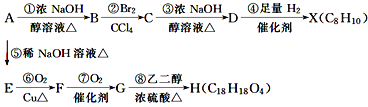
【题目】华法林(Warfarin)又名杀鼠灵,为心血管疾病的临床药物。其合成路线(部分反应条件略去) 如下所示:
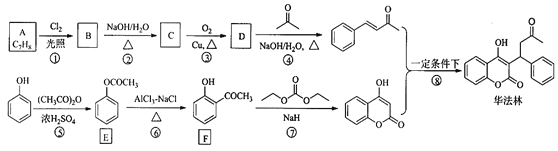
回答下列问题:
(1)A 的名称为________,E 中官能团名称为________。
(2)B 的结构简式为________。
(3)由 C 生成 D 的化学方程式为___________
(4)⑤的反应类型为_________,⑧的反应类型为________。
(5)F 的同分异构体中,同时符合下列条件的同分异构体共有___________种。
a.能与 FeCl3 溶液发生显色反应 b.含有-CHO
其中核磁共振氢谱为五组峰的结构简式为___________
【答案】甲苯 酯基 ![]()
![]() 取代反应 加成反应 13
取代反应 加成反应 13 ![]()
【解析】
由A的分子式及产物的性质,可确定A为![]() ,在光照条件下发生-CH3上的取代反应生成B(
,在光照条件下发生-CH3上的取代反应生成B(![]() ),B发生水解反应生成C(
),B发生水解反应生成C(![]() ),C催化氧化生成D(
),C催化氧化生成D(![]() ),D与CH3COCH3在NaOH、加热条件下发生羟醛缩合反应,生成
),D与CH3COCH3在NaOH、加热条件下发生羟醛缩合反应,生成![]() 和水。
和水。
(1)A为![]() ,名称为甲苯,E为
,名称为甲苯,E为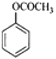 ,官能团名称为酯基。答案为:甲苯;酯基;
,官能团名称为酯基。答案为:甲苯;酯基;
(2)由以上分析知,B 的结构简式为![]() 。答案为:
。答案为:![]() ;
;
(3)C(![]() )催化氧化生成D(
)催化氧化生成D(![]() ),化学方程式为
),化学方程式为![]() 。答案为:
。答案为:![]() ;
;
(4)⑤为![]() 与(CH3CO)2O在浓硫酸的催化作用下反应生成
与(CH3CO)2O在浓硫酸的催化作用下反应生成 和CH3COOH,则反应类型为取代反应,⑧为
和CH3COOH,则反应类型为取代反应,⑧为![]() 与
与![]() 反应生成
反应生成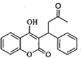 ,反应类型为加成反应。答案为:取代反应;加成反应;
,反应类型为加成反应。答案为:取代反应;加成反应;
(5)F 的同分异构体中,同时符合:a.能与 FeCl3 溶液发生显色反应、b.含有-CHO条件的同分异构体共有13种。它们为苯环上有-OH(酚)、-CH2CHO两个取代基的异构体3种,苯环上有-OH(酚)、-CHO、-CH3三个取代基的异构体10种。其中核磁共振氢谱为五组峰的结构简式为![]() 。答案为:13;
。答案为:13;![]() 。
。

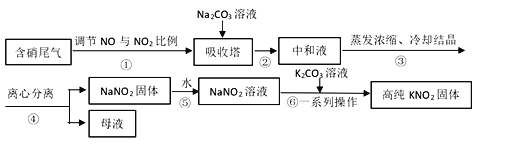
【题目】工业上常采用硝酸工业的含硝尾气制备亚硝酸钠,再利用亚硝酸钠制备亚硝酸钾,相关制备流程如下:
已知:①亚硝酸钠(NaNO2)是一种白色至浅黄色晶体或粉末,受热易分解,露置于空气中缓慢氧化。
②KMnO4在中性或碱性溶液中的还原产物为MnO2,在酸性条件下为Mn2+。
请回答:
(1)下列操作或描述正确的是________。
A. 步骤①调节NO与NO2比例使尾气被碱液充分吸收,且提高NaNO2产率
B. 在吸收塔中含硝尾气从底部通入,Na2CO3溶液从塔顶喷淋
C. 母液中溶质只有Na2CO3和NaNO3
D. 所得NaNO2固体产品中含有杂质NaNO3
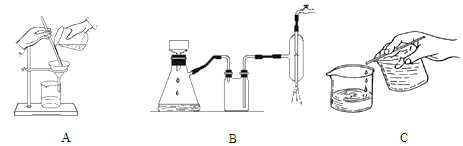
(2)离心分离是一种固液分离操作,步骤④可用以下三个操作中的________(选最佳)代替。
(3)NaNO2产品纯度分析。若用NaNO2待测液滴定酸性KMnO4标准溶液,终点现象是___,测定结果与真实值非常接近;而采用酸性KMnO4标准液滴定NaNO2待测液的方法进行测定,根据滴定结果计算NaNO2产品纯度总是大于100%,可能的原因是________。
(4)已知相关物质的溶解表如下:
物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
Na2CO3 | 7 | 21.5 | 49 | 46 | 43.9 |
K2CO3 | 105 | 111 | 117 | 127 | 140 |
NaNO2 | 71.2 | 80.8 | 94.9 | 111 | 113 |
KNO2 | 279 | 306 | 329 | 348 | 376 |
(i)根据相关物质溶解性信息,写出步骤⑥的化学方程式________。
(ii)步骤⑥正确的操作顺序为:b→_____→_____→c。
a 在85℃下蒸发浓缩,并不断将析出的Na2CO3晶体捞出
b 将NaNO2溶液与K2CO3溶液充分混合
c 离心分离,在60~70℃下干燥,迅速冷却,密封储存
d 热溶液冷却结晶获得高纯KNO2
【题目】己二酸是合成尼龙-66的主要原料之一。实验室合成己二酸的原理、有关数据如下:
3![]() +8HNO3→3
+8HNO3→3![]() +8NO↑+7H2O
+8NO↑+7H2O
物质 | 相对分子质量 | 密度(20℃) | 熔点 | 沸点 | 溶解性 |
环己醇 | 100 | 0.962 g/cm3 | 25.9℃ | 160.8℃ | 20℃时,在水中溶解度为3.6g,可混溶于乙醇、苯 |
己二酸 | 146 | 1.360 g/cm3 | 152℃ | 337.5℃ | 在水中的溶解度:15℃时1.44g,25℃时2.3g。易溶于乙醇,不溶于苯 |
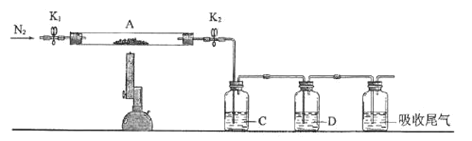
步骤Ⅰ:在如图装置的三颈烧瓶中加入16 mL 50%的硝酸(过量,密度为1.310 g/cm3),再加入1~2粒沸石,滴液漏斗中盛放有5.4 mL环己醇。

步骤Ⅱ:水浴加热三颈烧瓶至50℃左右,移去水浴,缓慢滴加5~6滴环己醇,摇动三口烧瓶,观察到有红棕色气体放出时再慢慢滴加剩下的环己醇,维持反应温度在60℃~65℃之间。
步骤Ⅲ:当环己醇全部加入后,将混合物用80℃~90℃水浴加热约10 min(注意控制温度),直至无红棕色气体生成为止。
步骤Ⅳ:趁热将反应液倒入烧杯中,放入冰水浴中冷却,析出晶体后抽滤、洗涤、干燥、称重。请回答下列问题:
(1)装置b的名称为__________,使用时要从_________(填“上口”或“下口”)通入冷水;滴液漏斗的细支管a的作用是________________。
(2)实验中,先将温度由室温升至50℃左右,再慢慢控制在60℃~65℃之间,最后控制在80℃~90℃,目的是____________________。
(3)本实验所用的50%的硝酸物质的量浓度为____________;实验中,氮氧化物废气(主要成分为NO和NO2)可以用NaOH溶液来吸收,其主要反应为NO+NO2+2NaOH == 2NaNO2+H2O。其中NaOH溶液可以用Na2CO3溶液来替代,请模仿上述反应,写出Na2CO3溶液吸收的方程式:______________________________________。
(4)为了除去可能的杂质和减少产品损失,可分别用冰水或______洗涤晶体。
(5)通过称量得到产物7.00 g,则本实验产率为__________(精确到0.1%)。