题目内容
【题目】现有某铁碳合金,某化学兴趣小组为了测定铁碳合金中铁的质量分数,并探究浓硫酸的还原产物,设计了如图所示的实验装置和实验方案(夹持仪器已省略),请你参与此项活动并回答相应问题:
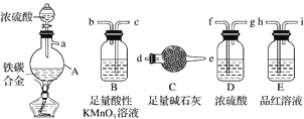
(1)该装置的连接顺序a___(填接口字母),连接好装置后,首先应进行的操作是____。
(2)mg铁碳合金中加入浓H2SO4,点燃酒精灯一段时间后,用滴管吸取A中的溶液滴入到适量水中作为试样,试样中所含金属离子的成分有以下三种可能:A:只含有Fe3+;B:只含有Fe2+;C:____,若为A,则A中反应的化学方程式为___,验证C种可能的实验方法___。
(3)待A中不再逸出气体时,停止加热,拆下C并称重,C增重bg。铁碳合金中铁的质量分数____(写表达式)。
(4)某同学认为利用此装置测得铁的质量分数偏大,请你写出可能的原因:_____。
(5)随着反应的进行,A中还可能发生某些离子反应。写出相应的离子方程式____。
【答案】hicbfgde 检查装置气密性 既有Fe2+,又有Fe3+ 2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O 取试样少许于试管中,先滴加少量的硫氰酸钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样于试管中,滴加少量的酸性KMnO4溶液,若紫色退去,证明溶液中含有Fe2+
CO2↑+2SO2↑+2H2O 取试样少许于试管中,先滴加少量的硫氰酸钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样于试管中,滴加少量的酸性KMnO4溶液,若紫色退去,证明溶液中含有Fe2+ ![]() 反应产生的CO2气体未能完全排到装置C中,则C增加的质量偏小,所以碳的质量会偏小,铁的质量分数会偏高 Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+
反应产生的CO2气体未能完全排到装置C中,则C增加的质量偏小,所以碳的质量会偏小,铁的质量分数会偏高 Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+
【解析】
(1)铁碳合金样品放入A中,再加入适量的浓硫酸加热,浓硫酸具有强氧化性和铁在加热条件下反应生成硫酸铁、二氧化硫和水;碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,二氧化硫具有漂白性,应先检验二氧化硫,用品红溶液,然后用过量高锰酸钾除去二氧化硫,用浓硫酸干燥后,剩余二氧化碳被碱石灰吸收,故连接顺序为:a hicbfgd e;在进行气体制备实验前,应先检查装置气密性;故答案为:hicbfgd e;检查装置气密性
(2)浓硫酸具有氧化性,与铁反应生成Fe3+,随着反应的进行浓硫酸浓度减小,逐渐变为稀硫酸,若铁足量,与稀硫酸反应生成Fe2+,若铁过量,过量的铁与Fe3+反应生成Fe2+,因此反应后的溶液中含有的金属离子成分可能有三种:A:只含有Fe3+;B:只含有Fe2+;C:既有Fe2+,又有Fe3+;铁碳合金样品放入A中,再加入适量的浓硫酸加热,浓硫酸具有强氧化性和铁在加热条件下反应生成硫酸铁、二氧化硫和水;碳和浓硫酸加热反应生成二氧化碳、二氧化硫和水,则A中反应的化学方程式为:2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,验证第三种可能的实验方法:取试样少许于试管中,先滴加少量的硫氰酸钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样于试管中,滴加少量的酸性KMnO4溶液,若紫色退去,证明溶液中含有Fe2+。
CO2↑+2SO2↑+2H2O,验证第三种可能的实验方法:取试样少许于试管中,先滴加少量的硫氰酸钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样于试管中,滴加少量的酸性KMnO4溶液,若紫色退去,证明溶液中含有Fe2+。
答案为:既有Fe2+,又有Fe3+;2Fe+6H2SO4(浓)![]() Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)
Fe2(SO4)3+3SO2↑+6H2O、C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;取试样少许于试管中,先滴加少量的硫氰酸钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样于试管中,滴加少量的酸性KMnO4溶液,若紫色退去,证明溶液中含有Fe2+;
CO2↑+2SO2↑+2H2O;取试样少许于试管中,先滴加少量的硫氰酸钾溶液,振荡后溶液显示红色证明有Fe3+;再取少许试样于试管中,滴加少量的酸性KMnO4溶液,若紫色退去,证明溶液中含有Fe2+;
(3)称取mg铁碳合金,加入过量浓硫酸,加热待A中不再逸出气体时,停止加热,拆下C装置并称重,C增重bg,则生成二氧化碳的质量为bg,根据质量守恒定律,则mg铁碳合金中含碳元素的质量=![]() ×12g/mol=
×12g/mol=![]() g,则含铁的质量为mg-
g,则含铁的质量为mg-![]() g,铁的质量分数=
g,铁的质量分数=![]() ×100%=
×100%=![]() ×100%。
×100%。
答案为:![]() ×100%
×100%
(4)反应产生的CO2气体未能完全排到装置C中,则C增加的质量偏小,所以碳的质量会偏小,铁的质量分数会偏高,故答案为:反应产生的CO2气体未能完全排到装置C中,则C增加的质量偏小,所以碳的质量会偏小,铁的质量分数会偏高;
(5)浓硫酸具有氧化性,与铁反应生成Fe3+,随着反应的进行浓硫酸浓度减小,逐渐变为稀硫酸,若铁足量,与稀硫酸反应生成Fe2+,若铁过量,过量的铁与Fe3+反应生成Fe2+,还可能发生的离子反应为:Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+;
答案为:Fe+2H+=Fe2++H2↑、2Fe3++Fe=3Fe2+;

【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I. 脱硝:
已知:H2的燃烧热为285.8kJ·mol1
N2(g)+2O2(g)=2NO2(g) ΔH=+133kJ·mol1
H2O(g)=H2O(l) ΔH=44kJ·mol1
催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为:______。
II. 脱碳:
(1)向2L密闭容器中加入2mol CO2和6mol H2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)
CH3OH(l)+H2O(l)
① 该反应自发进行的条件是_____(填“低温”、“高温”或“任意温度”)
② 下列叙述能说明此反应达到平衡状态的是_____。(填字母)
a. 混合气体的平均式量保持不变 b. CO2和H2的体积分数保持不变 c. CO2和H2的转化率相等
d. 混合气体的密度保持不变 e. 1 mol CO2生成的同时有3 mol HH键断裂
(2) 改变温度,使反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见表:
CH3OH(g)+H2O(g) ΔH<0中的所有物质都为气态。起始温度、体积相同(T1℃、2L密闭容器)。反应过程中部分数据见表:
反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
反应I:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 | ||||
反应II:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡常数K(I)___K(II)(填“>”“<”或“=”下同);平衡时CH3OH的浓度c(I)___c(II)。
②对反应I,前10min内的平均反应速率v(CH3OH)=_____。在其他条件不变的情况下,若30 min时只改变温度T2℃,此时H2的物质的量为3.2 mol,则T1____T2(填“>”、“<”或“=”)。若30 min时只向容器中再充入1 mol CO2(g)和1 mol H2O(g),则平衡_____移动(填“正向”、“逆向”或“不”)。