题目内容
【题目】实验室现有一包粉末状药品,可能由NaCl、 FeCl3 、 Al2(SO4)3中的一种或多种组成,某同学为确定其组成,进行如下实验(所加试剂均为过量)。请回答下列问题:
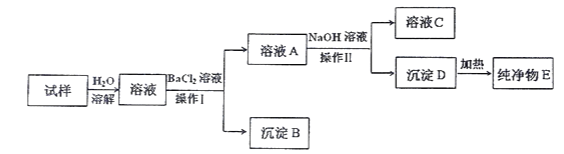
(1)操作Ⅰ的名称是___________。
(2)生产沉淀B的离子方程式为_________________________________。
(3)纯净物E是____________(填化学式,下同)。
(4)通过以上实验,确定该药品中一定含有______________,可能含有_________________。
【答案】 过滤 Ba2++SO42-=BaSO4↓ Fe2O3 FeCl3、Al2(SO4)3 NaCl
【解析】(1)从溶液中得到沉淀B应该是过滤;(2)能与氯化钡反应生成沉淀的是硫酸铝,则生产沉淀B的离子方程式为Ba2++SO42-=BaSO4↓。(3)溶液A中加入过量氢氧化钠溶液产生沉淀D,D加热得到纯净物E,由于一定存在硫酸铝,所以沉淀D只能是氢氧化铁,则纯净物E是Fe2O3。(4)通过以上实验可确定该药品中一定含有FeCl3、Al2(SO4)3,可能含有NaCl。

练习册系列答案
相关题目