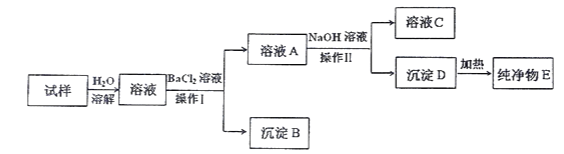
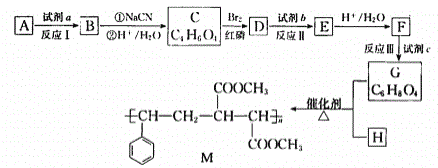
题目内容
【题目】某同学通过查阅资料得知,可利用Na2SO3粉末与70%硫酸溶液在加热条件下反应来快速制取SO2。该同学设计了下图所示装置制取SO2并验证其性质。
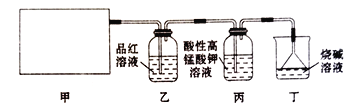
回答下列问题:
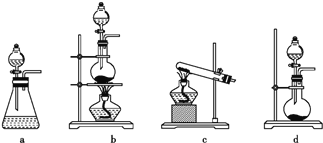
(1)根据资料中的相关信息,甲装置应选择下列装置中的____________(填序号)。
(2)实验过程中,丙装置中酸性高锰酸钾溶液紫红色褪去,说明SO2具有_________性,证明SO2具有漂白性的现象为___________________________________。
(3)丁装置的作用是____________,写出其中发生主要反应的化学方程式:______________________。
【答案】 )b 还原 品红褪色 吸收多余的SO2,防止污染空气 SO2 + 2NaOH= Na2SO3 + H2O
【解析】(1)根据资料中的相关信息,可利用Na2SO3粉末与70%硫酸溶液在加热条件下反应来快速制取SO2。甲装置是制取SO2的反应装置,应选择适合固体与液体加热反应制取气体的装置,故选b;(2)实验过程中,丙装置中酸性高锰酸钾溶液紫红色褪去,说明SO2被酸性高锰酸钾氧化,具有还原性,证明SO2具有漂白性的现象为品红褪色;(3)SO2直接排放到空气中会造成污染,丁装置的作用是吸收多余的SO2,防止污染空气,发生主要反应的化学方程式为:SO2 + 2NaOH= Na2SO3 + H2O。

 互动英语系列答案
互动英语系列答案【题目】相同温度下,体积均为0.25 L的两个密闭容器中发生反应:X2(g)+3Y2(g) ![]() 2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
2XY3(g) ΔH=-92.6 kJ·mol-1实验测得反应在起始、达到平衡时的有关数据如下表所示:
起始时各物质物质的量/mol | 达平衡时体系能量的变化 | |||
容器 | X2 | Y2 | XY3 | |
容器①恒温恒容 | 1 | 3 | 0 | 放热 23.15 kJ |
容器②恒温恒压 | 1 | 3 | 0 | Q(Q>0) |
下列叙述正确的是( )
A. 容器①、②中反应物X2的转化率相同
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
C. 容器①、②达到平衡时间相同
D. 容器②, Q大于23.15 kJ