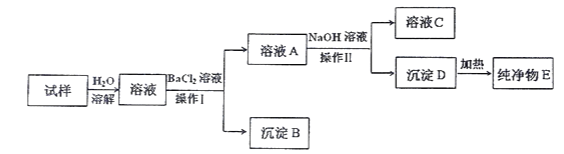
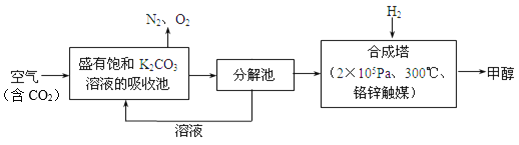
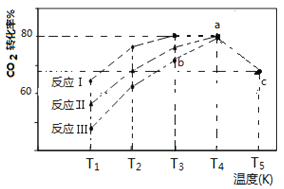
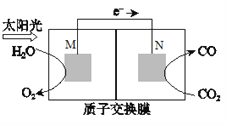
题目内容
【题目】氯化苄(C6H5CH2Cl)是一种重要的有机化工原料。工业上采用甲苯与干燥氯气在光照条件下反应合成氯化苄。
(1)写出甲苯与干燥氯气在光照条件下反应合成氯化苄的化学方程式________________。
(2)用下列方法分析氯化苄粗产品的纯度:
步骤I:称取2.555 g样品于烧瓶中,加入100.00 mL 4mol/L氢氧化钠溶液共热,冷却至室温。加入100.00 mL4mol/L硝酸,一段时间后,将烧瓶中的溶液全部转移至250.00 mL的容量瓶中,加水定容。
步骤II:从容量瓶中各取50.00 mL溶液于三只锥形瓶中,各加入25.00 mL0.2000mol/L硝酸银溶液。
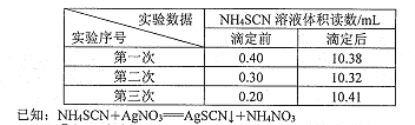
步骤m:用硫酸铁铵作指示剂,用0.2000 mol/LNH4SCN溶液分别滴定剩余的硝酸银,所得滴定数据如下表。
①加入硝酸的目的是____________。
②在步骤III操作中,判断达到滴定终点的现象是____。
③该样品中氯化苄的质量分数(写出计算过程)____。
④上述测定结果通常高于氯化苄中氯元素的理论含量,原因是___。
【答案】 C6H5CH3+Cl2![]() C6H5CH2Cl+HCl 中和NaOH使溶液呈酸性,防止OH—对下一步的干扰 当滴入最后一滴,溶液由无色变为红色,且半分钟内不褪色
C6H5CH2Cl+HCl 中和NaOH使溶液呈酸性,防止OH—对下一步的干扰 当滴入最后一滴,溶液由无色变为红色,且半分钟内不褪色 ![]() 甲苯与氯气在光照条件下可能生成多氯代物,Cl2或生成的HCl也会造成测定结果偏高
甲苯与氯气在光照条件下可能生成多氯代物,Cl2或生成的HCl也会造成测定结果偏高
【解析】(1)甲苯与干燥氯气在光照条件下反应合成氯化苄的化学方程式为C6H5CH3+Cl2![]() C6H5CH2Cl+HCl。(2)①溶液显碱性,则加入硝酸的目的是中和NaOH使溶液呈酸性,防止OH—对下一步的干扰。②铁离子能与SCN-反应使溶液显红色,则在步骤III操作中,判断达到滴定终点的现象是当滴入最后一滴,溶液由无色变为红色,且半分钟内不褪色。③三次实验中消耗标准液体积分别是9.98mL、10.02mL、10.21mL,第三次实验数据误差大,舍去,则消耗标准液体积的平均值是10.00mL,根据方程式可知剩余硝酸银是0.002mol,所以与氯离子反应的硝酸银是0.005mol-0.002mol=0.003mol,则水解生成的氯离子是0.003mol×250mL/50mL=0.015mol,因此该样品中氯化苄的质量分数为
C6H5CH2Cl+HCl。(2)①溶液显碱性,则加入硝酸的目的是中和NaOH使溶液呈酸性,防止OH—对下一步的干扰。②铁离子能与SCN-反应使溶液显红色,则在步骤III操作中,判断达到滴定终点的现象是当滴入最后一滴,溶液由无色变为红色,且半分钟内不褪色。③三次实验中消耗标准液体积分别是9.98mL、10.02mL、10.21mL,第三次实验数据误差大,舍去,则消耗标准液体积的平均值是10.00mL,根据方程式可知剩余硝酸银是0.002mol,所以与氯离子反应的硝酸银是0.005mol-0.002mol=0.003mol,则水解生成的氯离子是0.003mol×250mL/50mL=0.015mol,因此该样品中氯化苄的质量分数为![]() 。④由于甲苯与氯气在光照条件下可能生成多氯代物,且Cl2或生成的HCl也会造成测定结果偏高,因此上述测定结果通常高于氯化苄中氯元素的理论含量。
。④由于甲苯与氯气在光照条件下可能生成多氯代物,且Cl2或生成的HCl也会造成测定结果偏高,因此上述测定结果通常高于氯化苄中氯元素的理论含量。