题目内容
【题目】氨气是一种重要化合物,在工农业生产、生活中有重要作用。利用下图探究氨气的性质。
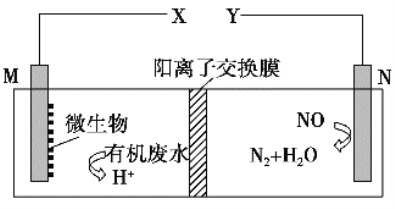
(1)收集气体,按下图玻璃装置进行实验。先打开旋塞①,B瓶中产生白色的烟,原因是______(用化学方程式表示);稳定后,关闭旋塞①,再打开旋塞②,B瓶中的现象是________。

(2)若将氯气和氨气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:________,该反应生成的还原产物的化学键类型是________。
(3)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):

①A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是_______。
②C装置中发生反应的化学方程式为________。
③反应后,装置E中除存在较多的H+外,还可能存在的一种离子是______,试设计实验证明这种离子的存在________。
④下列哪些装置可以同时起到装置D和E的作用_______ (填代号)。
【答案】 HCl+NH3=NH4Cl 烧杯中的AgNO3溶液会倒流进入到B瓶中,产生白色沉淀 3Cl2+8NH3=6NH4Cl+N2 离子键、共价键 Na2O2 4NH3+5O2![]() 4NO+6H2O NH4+ 取E中少许溶液放入一支洁净试管中,滴加氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明溶液中含有NH4+ b
4NO+6H2O NH4+ 取E中少许溶液放入一支洁净试管中,滴加氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明溶液中含有NH4+ b
【解析】分析:(1)氨气与氯化氢反应生成固体氯化铵,压强减小,硝酸银溶液进入B中;
(2)氯气具有强氧化性,能把氨气氧化为氮气,根据氯化铵是还原产物判断;
(3)①根据装置A中需要生成氨气和氧气分析;
②氨气发生催化氧化生成NO和H2O;
③根据铵根的性质解答;
④根据D装置起安全瓶的作用、E装置吸收气体的作用判断。
详解:(1)先打开旋塞①,氯化氢与氨气混合生成氯化铵,因此B瓶中产生白色的烟,反应的化学方程式为HCl+NH3=NH4Cl;稳定后,关闭旋塞①,再打开旋塞②,由于压强减小,因此硝酸银溶液进入B中,氯化铵与硝酸银反应生成氯化银白色沉淀,所以B瓶中的现象是烧杯中的AgNO3溶液会倒流进入到B瓶中,产生白色沉淀。
(2)若将氯气和氨气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,说明有氯化铵生成。另一生成物是空气的主要成分之一,为氮气,因此反应的化学方程式为3Cl2+8NH3=6NH4Cl+N2,该反应生成的还原产物是氯化铵,其中的化学键类型是离子键和共价键。
(3)①要模拟“氨的催化氧化”,则需要有氧气和氨气,由于A装置的分液漏斗中盛放浓氨水,且还要同时生成氧气,则烧瓶中盛放的药品应该是Na2O2。
②C装置中发生氨的催化氧化,则反应的化学方程式为4NH3+5O2![]() 4NO+6H2O。
4NO+6H2O。
③反应中氨气是过量的,氨气与酸反应生成铵盐,因此反应后,装置E中除存在较多的H+外,还可能存在的一种离子是NH4+,铵根能与碱反应生成氨气,则明这种离子的存在的实验是取E中少许溶液放入一支洁净试管中,滴加氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明溶液中含有NH4+。
④D装置起到安全瓶的作用,防止液体进入C装置。则a、导管口没有插入水中,不能充分吸收气体,a错误;b、氨气首先进入四氯化碳中,然后再被水吸收,可以起防倒吸作用,b正确;c、都扣的漏斗直接放在水中,不能起防倒吸作用,c错误;d、进气管很低,仍然不能起到防倒吸作用,d错误,答案选b。

 全优点练单元计划系列答案
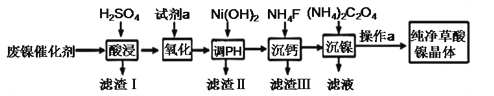
全优点练单元计划系列答案【题目】草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上用废镍催化剂(成分主要为Ni ,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(NiC2O4)= 4.05×1010
(1)“酸浸”前将废镍催化剂粉碎的目的是:____。“滤渣Ⅰ”的主要成分为:____。
(2)若试剂a为H2O2 ,写出氧化时反应的离子方程式:____。
(3)调节pH的范围为:____。
(4)写出“沉钙”操作中加入NH4F时发生反应的离子方程式:____,NH4F的电子式为:____。
(5)如果“沉镍”操作后测得滤液中C2O42 的浓度为0.18 mol·L1,则溶液中c(Ni2+)= ____ mol·L1。
(6)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍催化剂。该制备过程的化学方程式为:____。
【题目】铬是广泛存在于环境中的金属元素,在水体中主要以三价和六价铬的化合物为主,其中六价铬对人有害。通常含六价铬的酸性工业废水的处理流程为:
![]()
请回答下列问题:
I.(1)第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
a.Cr2O72-和CrO42-的浓度相同 b.2v (Cr2O72-) = v (CrO42-) c.溶液的颜色保持不变
(2)常温下,向100mL、0.1mol/L的K2CrO4溶液加入1mol/L硫酸10mL,存在平衡:
2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O K=5×1014
Cr2O72-(橙色)+H2O K=5×1014
若向上述溶液中加入浓KOH溶液,溶液的颜色由橙色渐变为黄色,反应逆转:Cr2O72-(橙色) +2OH-![]() 2CrO42-(黄色) +H2O
2CrO42-(黄色) +H2O
设该反应的平衡常数为K1,则K1=_______________。
II.为进一步研究初始pH和草酸浓度对第②步反应速率的影响,某学习小组设计对比实验如下表:
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
甲 | 4 | 60 | 10 | 30 |
乙 | 5 | x | 10 | 30 |
丙 | 5 | y | 5 | z |
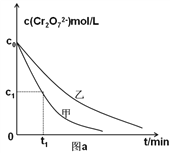
(3)实验设计表中z=_______mL;
(4)实验甲中0~t1时间段反应速率v(Cr3+)=________mol/(L·min) (用含字母的代数式表示)。
(5)常温下,第③步生成的Cr(OH)3在溶液中存在以下平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
【题目】X、Y、Z、M、R、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | |
原子半径 | 0.186 | 0.074 | 0.099 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
其他 | 阴离子无核外电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)X和M的原子可构成18电子的分子,该分子的分子式为______________。
(2)Z与Q相比,金属性较强的是______________(用元素符号表示),下列事实能证明一结论的是______________(填字母符号)。
A.Q的熔点比Z的熔点高,Q的硬度比Z的硬度大
B.Z与冷水反应迅速,而Q与冷水几乎不反应
C.Z的最高价氧化物对应水化物是强碱,而Q的最高价氧化物对应水化物具有两性
(3)与Y元素同主族的短周期元素E在自然界中存在多种核素,它们之间的关系互为_______________。
(4)写出Z2M2的电子式:___________________。