题目内容
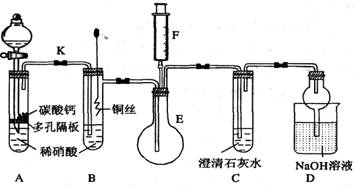
1. 某课外活动小组为了验证铜与稀硝酸反应产生的气体是NO而设计了下列实验,装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹,F是装有一半空气的注射器。
2. 
3. 请回答有关问题:
4. (1)设计装置A的目的是 ,如何判断已完成该目的__________________
5. (2)在完成(1)中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是 ;B中反应的离子方程式为: 。
6. (3)装置E和F的作用是 ;为实现此作用,其操作方法是 。
7. (4)装置D的作用是 。
【答案】
(1)利用生成的二氧化碳将整个装置内的空气赶尽,避免NO和氧气反应生成二氧化氮对气体产物的观察产生干扰。
装置C中产生白色沉淀时。
(2)铜丝表面产生气泡,稀硝酸液面上仍为无色,溶液变为监色:
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
(3)验证无色气体为N0;将注射器F中的空气推入E中或将E中的无色气体吸入到注射器中。
(4)吸收多余的氮氧化物,防止污染空气,兼有防止溶液倒吸的功能。
【解析】略

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
 已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: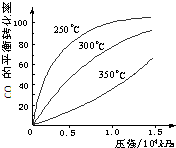 Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.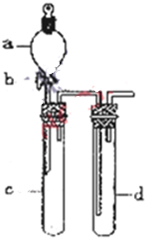 铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同.某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置.请你根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤.药品:稀硝酸、盐酸、Zn粒、CaCO3固体
铜与浓硝酸反应和铜与稀硝酸反应,产物不同,实验现象也不同.某课外活动小组为了证明并观察到铜与稀硝酸反应的产物为NO,设计了如图所示的实验装置.请你根据他们的思路,选择下列药品,完成该实验,并叙述实验步骤.药品:稀硝酸、盐酸、Zn粒、CaCO3固体