题目内容
利用X射线对BaSO4穿透能力较差的特性,医学上在进行消化系统的X射线透视时,常用BaSO4作内服造影剂,这种检查手段称为钡餐透视.Ⅰ.医学上进行钡餐透视时为什么不用BaCO3?
Ⅱ.某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4放入:①5mL水;②40mL 0.2mol?L-1Ba(OH)2溶液;③20mL 0.5mol?L-1Na2SO4溶液;④40mL 0.1mol?L-1H2SO4溶液中,溶解至饱和.
(1)以上各溶液中,Ba2+的浓度由大到小的顺序为
A.②>①>③>④B.②>①>④>③
C.①>④>③>②D.①>②>④>③
(2)已知298K时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液②中的S
浓度为
mol?L-1,溶解③中Ba2+的浓度为
(3)某同学取同体积的溶液②和溶液④直接混合,则混合液的pH为
BaCO3+2H+═Ba2++H2O+CO2↑
BaCO3+2H+═Ba2++H2O+CO2↑
(用离子方程式表示).Ⅱ.某课外活动小组为了探究BaSO4的溶解度,分别将足量BaSO4放入:①5mL水;②40mL 0.2mol?L-1Ba(OH)2溶液;③20mL 0.5mol?L-1Na2SO4溶液;④40mL 0.1mol?L-1H2SO4溶液中,溶解至饱和.
(1)以上各溶液中,Ba2+的浓度由大到小的顺序为
B
B
(填字母).A.②>①>③>④B.②>①>④>③
C.①>④>③>②D.①>②>④>③
(2)已知298K时,Ksp(BaSO4)=1.1×10-10,上述条件下,溶液②中的S
| O | 2- 4 |
mol?L-1,溶解③中Ba2+的浓度为
2.2×10-10
2.2×10-10
mol?L-1.(3)某同学取同体积的溶液②和溶液④直接混合,则混合液的pH为
13
13
(设混合溶液的体积为混合前两溶液的体积之和).分析:根据BaCO3的溶解平衡:BaCO3?Ba2++CO32-,H+能与CO32-反应生成水和二氧化碳,促进溶解平衡正向移动;
II.(1)含有相同的离子能抑制硫酸钡的溶解,难溶物质向更难溶物质进行转化;
(2)根据硫酸钡的溶度积常数计算硫酸根离子和钡离子浓度;
(3)先计算混合溶液中氢氧根离子浓度,再根据离子积公式计算氢离子浓度,从而确定溶液的pH值.
II.(1)含有相同的离子能抑制硫酸钡的溶解,难溶物质向更难溶物质进行转化;
(2)根据硫酸钡的溶度积常数计算硫酸根离子和钡离子浓度;
(3)先计算混合溶液中氢氧根离子浓度,再根据离子积公式计算氢离子浓度,从而确定溶液的pH值.
解答:解:硫酸钡不溶于水和酸,但胃酸可与CO32-反应生成水和二氧化碳,使CO32-浓度降低,从而使平衡BaCO3(s)?Ba2+(aq)+CO32-(aq) 向溶解方向移动,使Ba2+浓度增大,且Ba2+有毒,所以不能用碳酸钡代替硫酸钡,反应离子方程式为:
BaCO3+2H+═Ba2++H2O+CO2↑,
故答案为:BaCO3+2H+═Ba2++H2O+CO2↑;
Ⅱ(1)根据难溶电解质的溶度积常数知,溶液中硫酸根离子浓度越大,硫酸钡的溶解度越小,钡离子浓度越低,氢氧化钡能抑制硫酸钡的电离,但氢氧化钡溶液中含有钡离子,所以钡离子浓度最大;水中的钡离子浓度次之;硫酸钠溶液和硫酸溶液中都含有硫酸根离子,抑制硫酸钡的电离,硫酸钠中的硫酸根浓度大于硫酸中的浓度,所以硫酸钠溶液中钡离子的浓度小于硫酸溶液中钡离子浓度,所以钡离子浓度大小顺序是:②>①>④>③,故选B;
(2)②中C(SO4 2-)=
mol/L=5.5×10-10mol/L,③中C(Ba2+)=
mol/L=2.2×10-10mol/L,
故答案为:5.5×10-10mol/L,2.2×10-10mol/L;
(3)40ml 0.2mol?L-1的Ba(OH)2溶液和40ml 0.1mol?L-1的H2SO4溶液中混合后溶液中C(OH-)=
=0.1mol/L,则C(H+)=10-13 mol/L,所以pH=13,故答案为:13.
BaCO3+2H+═Ba2++H2O+CO2↑,
故答案为:BaCO3+2H+═Ba2++H2O+CO2↑;
Ⅱ(1)根据难溶电解质的溶度积常数知,溶液中硫酸根离子浓度越大,硫酸钡的溶解度越小,钡离子浓度越低,氢氧化钡能抑制硫酸钡的电离,但氢氧化钡溶液中含有钡离子,所以钡离子浓度最大;水中的钡离子浓度次之;硫酸钠溶液和硫酸溶液中都含有硫酸根离子,抑制硫酸钡的电离,硫酸钠中的硫酸根浓度大于硫酸中的浓度,所以硫酸钠溶液中钡离子的浓度小于硫酸溶液中钡离子浓度,所以钡离子浓度大小顺序是:②>①>④>③,故选B;
(2)②中C(SO4 2-)=
| 1.1×10-10 |
| 0.2 |
| 1.1×10-10 |
| 0.5mol/L |
故答案为:5.5×10-10mol/L,2.2×10-10mol/L;
(3)40ml 0.2mol?L-1的Ba(OH)2溶液和40ml 0.1mol?L-1的H2SO4溶液中混合后溶液中C(OH-)=
| (0.2-0.1)mol/L×2×0.04L |
| 0.04L×2 |
点评:本题考查了溶液中各种离子浓度大小的比较、混合溶液pH值的计算、平衡常数的计算等知识点,难度较大,注意酸碱混合溶液中pH值的计算时溶液的体积为混合体积,否则会导致错误.

练习册系列答案
相关题目
 ,上述条件下,溶液②中的
,上述条件下,溶液②中的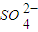 浓度为
浓度为