题目内容
 Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义.(1)已知:2SO2(g)+O2(g)?2SO3(g)△H=-Q1kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H=-Q2kJ?mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g) 的△H=
| Q2-Q1 |
| 2 |
| Q2-Q1 |
| 2 |
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,当测得上述反应平衡时NO2与NO体积比为1:3,则平衡常数K=
1.8
1.8
.(3)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)?CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图所示.该反应△H
<
<
0(填“>”或“<”).Ⅱ.已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性.
(1)用离子方程式解释Na2C2O4溶液显碱性的原因
C2O42-+H2O?HC2O4-+OH-
C2O42-+H2O?HC2O4-+OH-
;(2)常温下,比较0.1mol?L-1NaHC2O4溶液中各种离子浓度的大小关系
c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
;Ⅲ.某课外活动小组为了探究的BaSO4溶解度,分别将足量BaSO4放入:a.5ml 水;b.40ml 0.2mol?L-1的Ba(OH)2溶液;c.20ml 0.5mol?L-1的Na2SO4溶液;d.40ml 0.1mol?L-1的H2SO4溶液中,溶解至饱和.
(1)以上各溶液中,的浓度由大到小的顺序为
B
B
;A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
(2)某同学取同样的溶液b和溶液d直接混合,则混合溶液的pH值为
13
13
(设混合溶液的体积为混合前两溶液的体积之和).分析:Ⅰ.(1)2SO2(g)+O2(g)?2SO3(g)△H=-Q1kJ?mol-1 ①
2NO(g)+O2(g)?2NO2(g)△H=-Q2kJ?mol-1 ②
将方程式
即得方程式NO2(g)+SO2(g)?SO3(g)+NO(g),焓变进行相应的改变;
(2)根据平衡体系中各种气体的体积分数计算平衡常数;
(3)升高温度平衡向吸热反应方向移动,结合一氧化碳的转化率和温度的关系图片分析判断,从而确定反应的焓变;
Ⅱ.(1)Na2C2O4是强碱弱酸盐,水解后溶液呈碱性;
(2)根据溶液中酸根离子的电离和水解确定溶液中各种离子的浓度关系;
Ⅲ.(1)含有相同的离子能抑制硫酸钡的溶解,难溶物质向更难溶物质进行转化;
(2)先计算混合溶液中氢氧根离子浓度,再根据离子积公式计算氢离子浓度,从而确定溶液的pH值.
2NO(g)+O2(g)?2NO2(g)△H=-Q2kJ?mol-1 ②
将方程式
| ①-② |
| 2 |
(2)根据平衡体系中各种气体的体积分数计算平衡常数;
(3)升高温度平衡向吸热反应方向移动,结合一氧化碳的转化率和温度的关系图片分析判断,从而确定反应的焓变;
Ⅱ.(1)Na2C2O4是强碱弱酸盐,水解后溶液呈碱性;
(2)根据溶液中酸根离子的电离和水解确定溶液中各种离子的浓度关系;
Ⅲ.(1)含有相同的离子能抑制硫酸钡的溶解,难溶物质向更难溶物质进行转化;
(2)先计算混合溶液中氢氧根离子浓度,再根据离子积公式计算氢离子浓度,从而确定溶液的pH值.
解答:解:Ⅰ.(1)2SO2(g)+O2(g)?2SO3(g)△H=-Q1kJ?mol-1 ①
2NO(g)+O2(g)?2NO2(g)△H=-Q2kJ?mol-1 ②
将方程式
即得方程式NO2(g)+SO2(g)?SO3(g)+NO(g)△H=
,
故答案为:
;
(2)NO2(g)+SO2(g)?SO3(g)+NO(g),设反应开始时二氧化氮的体积为x,二氧化硫的体积为2x,反应达到平衡状态时,设二氧化氮反应的体积为y,该反应中二氧化氮和一氧化氮反应的体积比为1:1,所以生成的一氧化氮的体积为y,平衡时NO2与NO体积比为1:3,所以y=
x,则平衡时,二氧化氮的体积=x-
x=
x,二氧化硫的体积=2x-
x=
x,一氧化氮的体积=
x,三氧化硫的体积=
x,则平衡常数=
=1.8,故答案为:1.8;
(3)升高温度,一氧化碳的转化率降低,平衡向逆反应方向移动,即逆反应方向是吸热反应,则△H<0,故答案为:<;
Ⅱ.(1)草酸是弱酸,草酸钠是强碱弱酸盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,水解方程式为:C2O42-+H2O?HC2O4-+OH-,
故答案为:C2O42-+H2O?HC2O4-+OH-;
(2)NaHC2O4溶液中钠离子不水解,HC2O4-水解导致钠离子浓度比大HC2O4-,HC2O4-电离和水解,NaHC2O4溶液呈酸性说明HC2O4-电离程度大于水解程度,溶液中氢离子浓度大于氢氧根离子浓度,HC2O4-电离出氢离子和水电离出氢离子导致氢离子浓度大于C2O42-浓度,盐以电离为主水解为次,所以c(HC2O4-)>c(H+),所以溶液中各种离子浓度的大小关系为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
Ⅲ.(1)根据难溶电解质的溶度积常数知,溶液中硫酸根离子浓度越大,硫酸钡的溶解度越小,钡离子浓度越低,氢氧化钡能抑制硫酸钡的电离,但氢氧化钡溶液中含有钡离子,所以钡离子浓度最大;水中的钡离子浓度次之;硫酸钠溶液和硫酸溶液中都含有硫酸根离子,抑制硫酸钡的电离,硫酸钠中的硫酸根浓度大于硫酸中的浓度,所以硫酸钠溶液中钡离子的浓度小于硫酸溶液中钡离子浓度,所以钡离子浓度大小顺序是:b>a>d>c,故选B;
(2)40ml 0.2mol?L-1的Ba(OH)2溶液和40ml 0.1mol?L-1的H2SO4溶液中混合后溶液中C(OH-)=
=0.1mol/L,则C(H+)=10-13 mol/L,所以pH=13,故答案为:13.
2NO(g)+O2(g)?2NO2(g)△H=-Q2kJ?mol-1 ②
将方程式
| ①-② |
| 2 |
| Q2-Q1 |
| 2 |
故答案为:
| Q2-Q1 |
| 2 |
(2)NO2(g)+SO2(g)?SO3(g)+NO(g),设反应开始时二氧化氮的体积为x,二氧化硫的体积为2x,反应达到平衡状态时,设二氧化氮反应的体积为y,该反应中二氧化氮和一氧化氮反应的体积比为1:1,所以生成的一氧化氮的体积为y,平衡时NO2与NO体积比为1:3,所以y=
| 3 |
| 4 |
| 3 |
| 4 |
| 1 |
| 4 |
| 3 |
| 4 |
| 5 |
| 4 |
| 3 |
| 4 |
| 3 |
| 4 |
| ||||
|
(3)升高温度,一氧化碳的转化率降低,平衡向逆反应方向移动,即逆反应方向是吸热反应,则△H<0,故答案为:<;
Ⅱ.(1)草酸是弱酸,草酸钠是强碱弱酸盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,水解方程式为:C2O42-+H2O?HC2O4-+OH-,
故答案为:C2O42-+H2O?HC2O4-+OH-;
(2)NaHC2O4溶液中钠离子不水解,HC2O4-水解导致钠离子浓度比大HC2O4-,HC2O4-电离和水解,NaHC2O4溶液呈酸性说明HC2O4-电离程度大于水解程度,溶液中氢离子浓度大于氢氧根离子浓度,HC2O4-电离出氢离子和水电离出氢离子导致氢离子浓度大于C2O42-浓度,盐以电离为主水解为次,所以c(HC2O4-)>c(H+),所以溶液中各种离子浓度的大小关系为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-),故答案为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-);
Ⅲ.(1)根据难溶电解质的溶度积常数知,溶液中硫酸根离子浓度越大,硫酸钡的溶解度越小,钡离子浓度越低,氢氧化钡能抑制硫酸钡的电离,但氢氧化钡溶液中含有钡离子,所以钡离子浓度最大;水中的钡离子浓度次之;硫酸钠溶液和硫酸溶液中都含有硫酸根离子,抑制硫酸钡的电离,硫酸钠中的硫酸根浓度大于硫酸中的浓度,所以硫酸钠溶液中钡离子的浓度小于硫酸溶液中钡离子浓度,所以钡离子浓度大小顺序是:b>a>d>c,故选B;
(2)40ml 0.2mol?L-1的Ba(OH)2溶液和40ml 0.1mol?L-1的H2SO4溶液中混合后溶液中C(OH-)=
| 0.2mol/L×0.04L×2-0.1mol/L×0.04L×2 |
| 0.08L |
点评:本题考查了溶液中各种离子浓度大小的比较、混合溶液pH值的计算、平衡常数的计算等知识点,难度较大,注意酸碱混合溶液中pH值的计算时溶液的体积为混合体积,否则会导致错误.

练习册系列答案
相关题目
 (2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
(2011?山东)研究NO2、SO2、CO等大气污染气体的处理有重要意义.
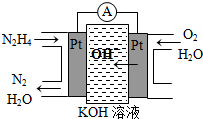 Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题
Ⅰ.肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂.试回答下列问题