题目内容
 已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
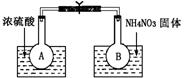
已知2NO2(g)?N2O4(g)△H(298K)=-52.7kJ?mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:Ⅰ.该小组的同学取了两个烧瓶A和B,分别加入相同浓度的NO2与N2O4的混合气体,中间用夹子夹紧,并将A和B浸入到已盛有水的两个烧杯中(如图所示),然后分别向两个烧杯中加入浓硫酸和NH4NO3固体.
请回答:
(1)A中的现象
气体颜色加深
气体颜色加深
,B中的现象气体颜色变浅
气体颜色变浅
;(2)由此可知,降低温度,该化学平衡向
正
正
(填“正”或“逆”)反应方向移动;(3)该化学反应的浓度平衡常数表达式为
Kc=
| [N2O4] |
| [NO2]2 |
Kc=
,升高温度,该反应中NO2的转化率将| [N2O4] |
| [NO2]2 |
减小
减小
(填“增大”、“减小”或“不变”).Ⅱ.在三支容积均为30cm3针筒中分别抽入10cm3NO2气体,将针筒前端封闭.
(1)将第二支针筒活塞迅速推至5cm3处,此时气体的颜色变深,一段时间后气体颜色又变浅了,但仍比第一支针筒气体的颜色深.
①推进针筒后颜色变深的原因是
气体的体积减小,NO2浓度增大,气体的颜色加深
气体的体积减小,NO2浓度增大,气体的颜色加深
;②一段时间后气体颜色又变浅的原因是
增大压强,减小气体的体积,平衡向正反应方向移动
增大压强,减小气体的体积,平衡向正反应方向移动
;③由此实验得出的结论是
增大压强,化学平衡向气态物质系数减小的方向移动
增大压强,化学平衡向气态物质系数减小的方向移动
.(2)将第三支针筒活塞快速拉至20cm3处,该同学观察到的现象是
气体的颜色先变浅,一段时间后又变深,但仍比第一支针筒气体的颜色浅
气体的颜色先变浅,一段时间后又变深,但仍比第一支针筒气体的颜色浅
;在此过程中,该反应的化学平衡常数将不变
不变
(填“增大”、“减小”或“不变”,下同),NO2的转化率将减小
减小
.分析:(1)浓硫酸稀释时放出热量,导致溶液的温度升高,硝酸铵溶解时吸收热量,导致溶液的温度降低,升高温度平衡向吸热方向移动,降低温度,平衡向放热方向移动;
(2)根据气体颜色的变化确定移动方向;
(3)Kc=
; 升高温度,平衡向吸热反应方向移动,根据平衡移动方向确定二氧化氮的转化率;
Ⅱ.(1)减小体积,二氧化氮的浓度增大,则气体颜色加深,同时增大气体压强,根据勒夏特列原理分析解答;
(2)增大气体体积,压强减小,平衡向气体体积增大的方向移动,温度不变,化学平衡常数不变,根据平衡移动方向判断二氧化氮的转化率.
(2)根据气体颜色的变化确定移动方向;
(3)Kc=
| C(N2O4) |
| C2(NO2) |
Ⅱ.(1)减小体积,二氧化氮的浓度增大,则气体颜色加深,同时增大气体压强,根据勒夏特列原理分析解答;
(2)增大气体体积,压强减小,平衡向气体体积增大的方向移动,温度不变,化学平衡常数不变,根据平衡移动方向判断二氧化氮的转化率.
解答:解:(1)浓硫酸稀释时放出热量,导致溶液的温度升高,硝酸铵溶解时吸收热量,导致溶液的温度降低,反应2NO2(g)?N2O4(g)是放热反应,A烧杯中,升高温度,平衡向逆反应方向移动,二氧化氮气体浓度增大,气体颜色加深,降低温度,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅,故答案为:气体颜色加深,气体颜色变浅;
(2)由以上分析知,降低温度,平衡向正反应方向移动,故答案为:正;
(3)Kc=
,升高温度,平衡向逆反应方向移动,导致二氧化氮转化率降低,
故答案为:Kc=
; 减小;
Ⅱ.(1)①气体的体积减小时,NO2浓度增大,则气体颜色加深,
故答案为:气体的体积减小,NO2浓度增大,气体的颜色加深;
②气体体积减小,则气体压强增大,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅,
故答案为:增大压强,减小气体的体积,平衡向正反应方向移动;
③增大压强,化学平衡向气态物质系数减小的方向移动,故答案为:增大压强,化学平衡向气态物质系数减小的方向移动;
(2)气体体积增大,二氧化氮浓度减小,所以气体颜色变浅,同时气体的压强减小,平衡向逆反应方向移动,二氧化氮的浓度增大,但仍不如第一支针筒气体的浓度大,所以仍比第一支针筒气体的颜色浅;化学平衡常数只与温度有关,温度不变,化学平衡常数不变,平衡向逆反应方向移动,所以二氧化氮的转化率减小,
故答案为:气体的颜色先变浅,一段时间后又变深,但仍比第一支针筒气体的颜色浅,不变,减小.
(2)由以上分析知,降低温度,平衡向正反应方向移动,故答案为:正;
(3)Kc=
| C(N2O4) |
| C2(NO2) |
故答案为:Kc=
| C(N2O4) |
| C2(NO2) |
Ⅱ.(1)①气体的体积减小时,NO2浓度增大,则气体颜色加深,
故答案为:气体的体积减小,NO2浓度增大,气体的颜色加深;
②气体体积减小,则气体压强增大,平衡向正反应方向移动,二氧化氮浓度降低,所以气体颜色变浅,
故答案为:增大压强,减小气体的体积,平衡向正反应方向移动;
③增大压强,化学平衡向气态物质系数减小的方向移动,故答案为:增大压强,化学平衡向气态物质系数减小的方向移动;
(2)气体体积增大,二氧化氮浓度减小,所以气体颜色变浅,同时气体的压强减小,平衡向逆反应方向移动,二氧化氮的浓度增大,但仍不如第一支针筒气体的浓度大,所以仍比第一支针筒气体的颜色浅;化学平衡常数只与温度有关,温度不变,化学平衡常数不变,平衡向逆反应方向移动,所以二氧化氮的转化率减小,
故答案为:气体的颜色先变浅,一段时间后又变深,但仍比第一支针筒气体的颜色浅,不变,减小.
点评:本题考查了温度、压强对化学平衡的影响,难度不大,根据勒夏特里原理来分析解答即可.

练习册系列答案
相关题目
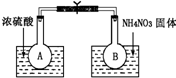 已知2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1,常温下N2O4为无色气体.某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
已知2NO2(g)═N2O4(g)△H=-52.7kJ?mol-1,常温下N2O4为无色气体.某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验:
N2O4(g) ΔH(298K)=-52.7kJ·mol-1,某课外活动小组为了探究温度和压强对化学平衡的影响,做了如下两组实验: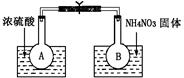
 N2O4(g) ΔH(298K)=-52.7kJ·mol-1。
N2O4(g) ΔH(298K)=-52.7kJ·mol-1。