题目内容
【题目】对于反应2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是( )
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是( )
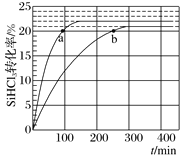
A.该反应的△H>0
B.a、b处反应速率大小关系:va大于vb
C.在343 K下,要提高SiHCl3转化率,可以及时移去产物或提高反应物浓度
D.343 K时,SiHCl3的平衡转化率为22%,可以求得该温度下的平衡常数约为0.02
【答案】C
【解析】
温度越高反应越快,达到平衡用的时间就越少,所以曲线a代表343K的反应,曲线b代表323K的反应。
A、曲线a代表343K的反应,曲线b代表323K的反应,由图像可知,温度越高SiHCl3的平衡转化率越大,所以该反应的△H>0,故A正确;
B、a、b两点的转化率相等,可以认为各物质的浓度对应相等,而a点的温度更高,所以速率更快,即Va>Vb,故B正确;
C、 2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)只有一种反应物,增大反应物的浓度,相当于加压,反应前后气体系数和不变,加压平衡不移动,提高反应物浓度,SiHCl3的转化率不变,故C错误;
SiH2Cl2(g)+SiCl4(g)只有一种反应物,增大反应物的浓度,相当于加压,反应前后气体系数和不变,加压平衡不移动,提高反应物浓度,SiHCl3的转化率不变,故C错误;
D、设初始加入的三氯氢硅的浓度为1 mol·L-1,
2SiHCl3(g)![]() SiH2Cl2(g)+SiCl4(g)
SiH2Cl2(g)+SiCl4(g)
起始: 1 0 0
反应: 0.22 0.11 0.11(转化率为22%)
平衡: 0.78 0.11 0.11
所以平衡常数K=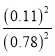 =0.02,故D正确;
=0.02,故D正确;
选C。

练习册系列答案
 灵星计算小达人系列答案
灵星计算小达人系列答案
相关题目