题目内容
17.虽然氟元素早在1810年就被发现,但170多年来化学家试图用化学方法制取氟单质的尝试一直未获成功.直到1986年,化学家Karl Chrisie首次用化学方法制得了F2,他提出的三步反应如下:①KMnO4+KF+H2O2+HF-→K2MnF6+O2+H2O
②SbCl5+HF═SbF5+5HCl
③2K2MnF6+4SbF5═4KSbF6+2MnF3+F2↑
请根据以上信息回答下列问题:
(1)反应①中空格上应填物质的化学式为O2.
(2)反应②是否为氧化还原反应否(选填“是”、“否”或“无法确定”).
(3)反应③中的氧化剂为K2MnF6,被氧化的元素为F.
(4)每生成1mol F2,消耗KMnO4的物质的量为2mol.
分析 (1)双氧水能被高锰酸钾氧化为氧气单质;
(2)反应中没有元素化合价的变化;
(3)化合价升高元素失去电子,被氧化,所在反应物是还原剂,对应产物是氧化产物;化合价降低元素得到电子,被还原,所在的反应物是氧化剂,对应产物是还原产物;
(4)根据方程式中物质的物质的量关系计算.
解答 解:(1)化合价降低元素所在的反应物是氧化剂,KMnO4中Mn化合降低,所以是氧化剂,双氧水能被高锰酸钾氧化为氧气单质,
故答案为:O2;
(2)SbCl5+HF═SbF5+5HCl反应中没有元素化合价的变化,不是氧化还原反应,
故答案为:否;
(3)反应2K2MnF6+4SbF5→4KSbF6+2MnF3+F2↑中,K2MnF6中Mn元素的化合价降低,所以K2MnF6是氧化剂,SbF5中F元素化合价升高,被氧化,所以SbF5是还原剂,故答案为:K2MnF6;F;
(4)2K2MnF6+4SbF5═4KSbF6+2MnF3+F2↑,反应中生成1molF2时,消耗2molKMnO4;
故答案为:2mol.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
7.为回收利用废钒催化剂(含有V2O5,、及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如图1:
已知部分含钒物质在水中的溶解性如下:
回答下列问靥:
(1)工业由V2O5冶炼金厲钒常用铝热法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(2)滤液中含钒的主要成分为VOSO4 (写化学式).
(3)反应③的沉淀率是回收钒的关键,该步反应的离子方程式为NH4++VO3-=NH4VO3↓;沉淀率的髙
低除受溶液pH影响外,还与氯化按系数(NH4Cl加入质量与样品中V2O5的质量比)和温度有关.根据图2判断最佳氯化铵系数和温度分别为4、80°C.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,该滴定反应的离子方程式2VO2++H2C2O4+2H+═2VOn++2CO2↑+2H2O.若产生2.24L的CO2(标准状况下),则转移电子数为0.1NA.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO${\;}_{2}^{+}$+V2++H+ $?_{放电}^{充电}$ VO2++H2O+V3+
电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.
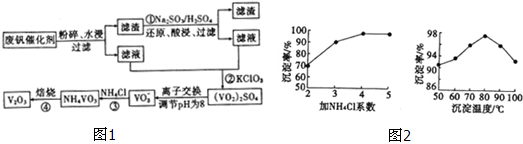
已知部分含钒物质在水中的溶解性如下:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
(1)工业由V2O5冶炼金厲钒常用铝热法,写出该反应的化学方程式3V2O5+10Al$\frac{\underline{\;高温\;}}{\;}$6V+5Al2O3.
(2)滤液中含钒的主要成分为VOSO4 (写化学式).
(3)反应③的沉淀率是回收钒的关键,该步反应的离子方程式为NH4++VO3-=NH4VO3↓;沉淀率的髙
低除受溶液pH影响外,还与氯化按系数(NH4Cl加入质量与样品中V2O5的质量比)和温度有关.根据图2判断最佳氯化铵系数和温度分别为4、80°C.
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,该滴定反应的离子方程式2VO2++H2C2O4+2H+═2VOn++2CO2↑+2H2O.若产生2.24L的CO2(标准状况下),则转移电子数为0.1NA.
(5)全矾液流电池的电解质溶液为VOSO4溶液,电池的工作原理为:VO${\;}_{2}^{+}$+V2++H+ $?_{放电}^{充电}$ VO2++H2O+V3+
电池充电时阳极的电极反应式为VO2++H2O-e-=VO2++2H+.

5.盛放下列试剂的试剂瓶不能用玻璃塞的是( )
| A. | 氢氧化钠溶液 | B. | 盐酸 | C. | 硫酸钠溶液 | D. | AgNO3溶液 |
9.下列由相关实验现象所推出的结论正确的是( )
| A. | Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 | |
| B. | HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 | |
| C. | Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应 | |
| D. | 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
6.下列各组物质中,相互间一定互为同系物的是( )
| A. | C4H10和C20H42 | B. | 邻二甲苯和对二甲苯 | ||
| C. | C4H8和C3H6 | D. | C2H2和C4H6 |
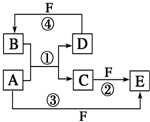 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).