题目内容
【题目】将等物质的量的硫酸铝和硫酸铵溶于水形成VL混合溶液,逐渐加入氢氧化钠溶液,直至过量。下列表示氢氧化钠溶液加入的体积(X)与溶液中沉淀的量(Y)关系示意图正确的是
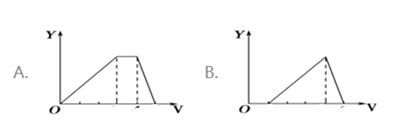
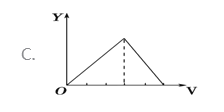
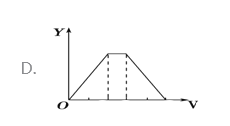
A. A B. B C. C D. D
【答案】A
【解析】假定溶液中含有硫酸铝和硫酸铵的物质的量分别为1mol,开始滴加NaOH发生反应为:Al3++3OH-=Al(OH)3↓,沉淀逐渐增大,当Al3+沉淀完全时需加入6molOH-,即加入6molNaOH,生成Al(OH)32mol,沉淀量达最大值;然后发生反应为:NH4++OH-=NH3H2O;NH4+完全反应时需加入2molOH-,即加入2molNaOH,沉淀氢氧化铝的量不变;最后继续滴加NaOH,2molAl(OH)3溶解,发生反应Al(OH)3+OH-=AlO2-+2H2O,由方程式可知要使2molAl(OH)3完全溶解,需再加入2molNaOH。三阶段消耗NaOH的物质的量之比为6mol:2mol:2mol=3:1:1,三阶段消耗NaOH溶液的体积比为3:1:1,选项A符合题意,答案选A。

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目