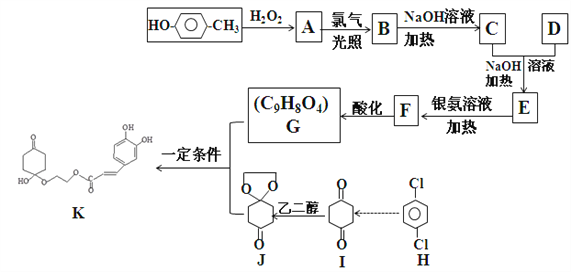
题目内容
【题目】设NA代表阿伏加德罗常数的值,下列说法不正确的是( )
A. lmolNa2O2与足量水反应,转移的电子数为NA
B. 标准状况下,2.24LCl2与足量铁粉反应转移的电子数为0.2NA
C. 6.0g二氧化硅含有的Si-O键数为0.4NA
D. 2mol硫在空气中完全燃烧,消耗O2的分子数为3NA
【答案】D
【解析】A. 因为2Na2O2+2H2O=4NaOH+O2![]() 所以lmolNa2O2与足量水反应,转移的电子数为NA,故A正确;B. 因为2Fe+3Cl2
所以lmolNa2O2与足量水反应,转移的电子数为NA,故A正确;B. 因为2Fe+3Cl2![]() 2FeCl3根据电子守恒规律,标准状况下,2.24LCl2为1mol,与足量铁粉反应转移的电子数为0.2NA,故B正确;C.因为每个硅原子形成4个Si-O键, 6.0g二氧化硅含有0.1mol硅原子,含Si-O键数为0.4NA,故C正确;D. 因为
2FeCl3根据电子守恒规律,标准状况下,2.24LCl2为1mol,与足量铁粉反应转移的电子数为0.2NA,故B正确;C.因为每个硅原子形成4个Si-O键, 6.0g二氧化硅含有0.1mol硅原子,含Si-O键数为0.4NA,故C正确;D. 因为![]() ,所以2mol硫在空气中完全燃烧,消耗O2的分子数为2NA,故D错;答案:D。
,所以2mol硫在空气中完全燃烧,消耗O2的分子数为2NA,故D错;答案:D。
点燃

练习册系列答案
相关题目