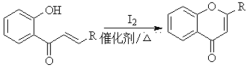
题目内容
【题目】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。Deacon发明的直接氧化法将HCl气体直接氧化成Cl2,方程式为:4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ/mol。400℃时,将4molHCl和4molO2(g)气体通入一容积固定为2L的密闭容器中,回答下列问题:
2Cl2(g)+2H2O(g) ΔH=-116kJ/mol。400℃时,将4molHCl和4molO2(g)气体通入一容积固定为2L的密闭容器中,回答下列问题:
(1)该反应的平衡常数表达式为___,K(300℃)___K(400℃)(填“<”,“=”或“>”)。
(2)若平衡时a(HCl)为80%,在相同条件下,密闭容器的体积缩小为1L,此反应达平衡时放出的热量(Q)可能是___(填字母序号)kJ。
A.0<Q<58 B.92.8<Q<116 C.371.2<Q<464 D.116<Q<232
(3)在一定条件下,体系中HCl的平衡转化率与L和X的关系如图所示,L和X分别表示温度或压强。

i.X表示的物理量是___。
ii.判断L1与L2的大小关系:L1___L2(填“<”,“=”或“>”)。
(4)若已知达平衡时,该容器内混合气体总压强为P,混合气体起始压强为P0,反应物HCl的转化率a(HCl)为___(请用P0、P来表示),有利于提高HCl平衡转化率的条件是___(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
【答案】K=![]() > B 温度 > 4(P0-P)/P0 B
> B 温度 > 4(P0-P)/P0 B
【解析】
(1)根据4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) ΔH=-116kJ/mol可知该反应的平衡常数表达式为K=
2Cl2(g)+2H2O(g) ΔH=-116kJ/mol可知该反应的平衡常数表达式为K=![]() ;反应是反热反应,K值与温度成反比,所以K(300℃)>K(400℃)。
;反应是反热反应,K值与温度成反比,所以K(300℃)>K(400℃)。
(2)若平衡时a(HCl)为80%,则放热为116kJ×80%=92.8kJ,在相同条件下,密闭容器的体积缩小为1L,相当于加压,平衡向着体积减小的方向移动,所以放热增加,但是反应为可逆反应,放出热量达不到116kJ,答案为:B;
(3)正反应是体积减小的放热反应,则由图像可知X表示的物理量是温度,温度越高转化率越低,则判断L1与L2的大小关系:L1>L2;
(4) 4HCl(g)+O2(g)![]() 2Cl2(g)+2H2O(g) 气体减少
2Cl2(g)+2H2O(g) 气体减少
系数 4 1 2 2 1
起始(mol) 4 4 0 0
转化(mol) 4(P0-P) P0-P
故HCl的转化率a(HCl)=4(P0-P)/P0;
正反应是体积减小的放热反应,则低温高压有利于提高HCl平衡转化率,答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案