题目内容
7.常温下,下列各组粒子在指定溶液中能大量共存的是( )| A. | 含大量Fe3+的溶液中:NH4+、Mg2+、Cl-、HSO3- | |
| B. | 加入Al有H2生成的溶液中:Na+、NH4+、Cl-、NO3- | |
| C. | NaOH溶液中:K+、Na+、AlO2-、CO32- | |
| D. | NaHCO3溶液中:K+、Al3+、Cl-、SO42- |
分析 A.铁离子能够氧化亚硫酸氢根离子;
B.该溶液为酸性或强碱性溶液,铵根离子与氢氧根离子反应,酸性条件下硝酸根离子具有强氧化性,加入铝不会生成氢气;
C.四种离子之间不反应,都不与氢氧化钠反应;
D.碳酸氢钠与铝离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体.
解答 解:A.Fe3+、HSO3-之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.加入Al有H2生成的溶液中存在大量氢离子或氢氧根离子,NH4+与氢氧根离子反应,NO3-在酸性溶液中具有强氧化性,加入铝不会生成氢气,故B错误;
C.K+、Na+、AlO2-、CO32-离子之间不发生反应,且都不与NaOH反应,在溶液中能够大量共存,故C正确;
D.NaHCO3与Al3+发生双水解反应,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考中的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
17.某小组同学利用图1装置(夹持仪器已省略)制备溴苯,并探究该反应原理.
Ⅰ.制备溴苯
(1)装置中长导管a的作用是冷凝回流、导出气体.
(2)本实验所获得的溴苯为褐色,是因为溴苯溶解了过量的溴.
Ⅱ.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃.同学们设计了如图2流程:
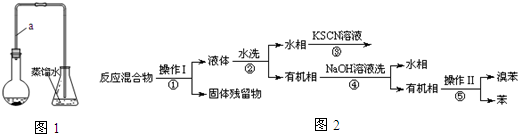
(3)操作Ⅱ为蒸馏.
(4)流程②和④中,需要用到的玻璃仪器是烧杯、分液漏斗;流程③的现象为溶液变血红色(或红色),流程④的作用是除去溴苯中的溴.
Ⅲ.探究原理
(5)反应结束后,某同学取少量锥形瓶中的液体于试管中,再滴入几滴AgNO3溶液,出现浅黄色浑浊,从而判断反应一定生成了HBr.你认为该同学的判断不合理(填“合理”、“不合理”).
(6)为探究锥形瓶中溶液的离子,请完成如表探究实验方案(限选试剂:镁粉、四氯化碳、氯水、溴水、蒸馏水)
根据上述结论推断,制备溴苯的反应属于取代反应,其反应方程式为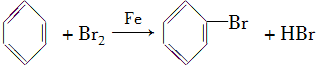 .
.
Ⅰ.制备溴苯
(1)装置中长导管a的作用是冷凝回流、导出气体.
(2)本实验所获得的溴苯为褐色,是因为溴苯溶解了过量的溴.
Ⅱ.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃.同学们设计了如图2流程:

(3)操作Ⅱ为蒸馏.
(4)流程②和④中,需要用到的玻璃仪器是烧杯、分液漏斗;流程③的现象为溶液变血红色(或红色),流程④的作用是除去溴苯中的溴.
Ⅲ.探究原理
(5)反应结束后,某同学取少量锥形瓶中的液体于试管中,再滴入几滴AgNO3溶液,出现浅黄色浑浊,从而判断反应一定生成了HBr.你认为该同学的判断不合理(填“合理”、“不合理”).
(6)为探究锥形瓶中溶液的离子,请完成如表探究实验方案(限选试剂:镁粉、四氯化碳、氯水、溴水、蒸馏水)
| 实验步骤 | 预期现象 | 结论 |
| 1.将锥形瓶中的液体转入分液漏斗,加足量①四氯化碳,振荡后分液.分别取少量②上层溶液于试管A、B中 | ||
| 2.向试管A中加入少量③和四氯化碳,振荡后静置; | 溶液分层,下层显④红棕(橙红色也可以)色 | 锥形瓶中液体含大量Br- |
| 3.向试管B中加入⑤镁粉. | 有汽泡生成 | 锥形瓶中液体含大量⑥H+ |
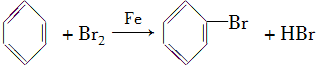 .
.
18.下列分子只表示一种物质的是( )
| A. | C3H7Cl | B. | C3H6 | C. | CH2Cl2 | D. | C4H10 |
15.下列反应中属于取代反应的是( )
| A. | 乙烯使酸性高锰酸钾溶液褪色 | |
| B. | 苯与氢气在一定条件下反应生成环己烷 | |
| C. | 苯与浓硝酸和浓硫酸的混合液反应生成油状液体 | |
| D. | 乙烯与溴的四氯化碳溶液反应 |
2.I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示.
其中Y所处的周期序数与族序数相等.按要求回答下列问题:
(1)写出X的原子结构示意图 .
.
(2)列举一个事实说明W非金属性强于Z:2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(用化学方程式表示)
II.运用所学化学原理,解决下列问题:
(3)已知:Si+2NaOH+H2O═Na2SiO3+2H2↑.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si-4e-+6OH-=SiO32-+3H2O;
(4)已知:①C(s)+O2(g)═CO2(g)△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g)△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s)△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1;
(5)已知:CO(g)+H2O(g) $?_{△}^{催化剂}$ H2(g)+CO2(g).右表为该反应在不同温度时的平衡常数.
则:该反应的△H<0(填“<”或“>”);500℃时进行该反应,且CO和H2O起始浓度相等,CO平衡转化率为75%.
| X | ||||
| Y | Z | W |
(1)写出X的原子结构示意图
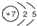 .
.(2)列举一个事实说明W非金属性强于Z:2HClO4+Na2SiO3=2NaClO4+H2SiO3↓(用化学方程式表示)
II.运用所学化学原理,解决下列问题:
(3)已知:Si+2NaOH+H2O═Na2SiO3+2H2↑.某同学利用单质硅和铁为电极材料设计原电池(NaOH为电解质溶液),该原电池负极的电极反应式为Si-4e-+6OH-=SiO32-+3H2O;
(4)已知:①C(s)+O2(g)═CO2(g)△H=a kJ•mol-1;
②CO2(g)+C(s)═2CO(g)△H=b kJ•mol-1;
③Si(s)+O2(g)═SiO2(s)△H=c kJ•mol-1.
工业上生产粗硅的热化学方程式为2C(s)+SiO2(s)=Si(s)+2CO(g)△H=(a+b-c)kJ•mol-1;
(5)已知:CO(g)+H2O(g) $?_{△}^{催化剂}$ H2(g)+CO2(g).右表为该反应在不同温度时的平衡常数.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
12.利用下列实验装置能完成相应实验的是( )
| A. |  装置测定化学反应速率 | B. | 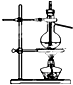 装置模拟海水蒸馏 | ||
| C. | 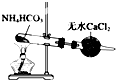 装置制备纯净的NH3 | D. | 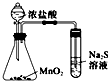 装置比较MnO2、Cl2、S的氧化性 |
19.下列有关糖类、油脂和蛋白质的叙述正确的是( )
| A. | 油脂的水解反应又叫做皂化反应 | |
| B. | 一定条件下,糖类都能发生水解反应 | |
| C. | 蛋白质发生变性后,直接生成氨基酸 | |
| D. | 通过灼烧时产生的气味可以鉴别蚕丝和棉纱 |
14.下表是元素周期表示意图的一部分,根据A~I在元素周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素化学性质最不活泼的是Ne,只有负化合价而无正化合价的是F,非金属性最强的元素是F,金属性最强的元素是Na.
(2)表中元素最高价氧化物的水化物的碱性最强的化合物是NaOH,酸性最强的化合物是HClO4,呈两性的化合物是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是HF.
| 周期/族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)表中元素最高价氧化物的水化物的碱性最强的化合物是NaOH,酸性最强的化合物是HClO4,呈两性的化合物是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是HF.