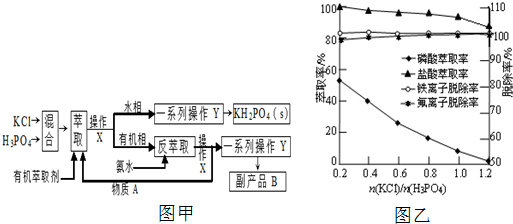
题目内容
4.向某溶液中加入BaCl2溶液,生成白色沉淀,加入稀硝酸沉淀不消失,则下列关于溶液中所含离子的推断中正确的( )| A. | 一定含有SO42- | B. | 含有SO42- 或Ag+ | ||
| C. | 含有SO42- 或Ag+ 或SO32- | D. | 可能含有SO32- 或CO32- |
分析 加入稀硝酸酸化,没有明显变化,溶液中一定不存在碳酸根离子和碳酸氢根离子;再加入BaCl2溶液,产生白色沉淀,白色沉淀可能为氯化银、硫酸钡;原溶液中可能存在硫酸根离子、银离子、亚硫酸根离子,据此进行解答.
解答 解:加入BaCl2溶液,产生白色沉淀,该白色沉淀可能为AgCl、BaSO3、BaSO4、BaCO3,由于稀硝酸具有强氧化性,所以原溶液中可能含有Ag+、SO42-、SO32-,SO32-可被氧化生成SO42-,BaCO3可溶于稀硝酸,
但Ag+不与SO42-、SO32-同时存在,
根据以上分析可知,溶液中一定不存在CO32-,溶液中可能含有Ag+,溶液中可能含有SO42-或SO32-,
故选C.
点评 该题是高考中的常见考点,属于中等难度的试题.试题综合性强,贴近高考,有利于培养硝酸的逻辑思维能力和创新思维能力.该题的关键是要明确在进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可.

练习册系列答案
相关题目
15.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体,这些气体与3.2g O2混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入NaOH溶液至Cu2+恰好完全沉淀,则消耗溶液中NaOH的质量是( )
| A. | 16g | B. | 32g | C. | 64g | D. | 无法计算 |
12.下列不属于晶体特点的是( )
| A. | 有固定的几何外形 | B. | 一定有各向异性 | ||
| C. | 一定有固定的熔点 | D. | 一定是无色透明的固体 |
19.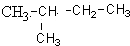 的命名正确的是( )
的命名正确的是( )
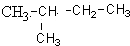 的命名正确的是( )
的命名正确的是( )| A. | 3-甲基丁烷 | B. | 2-甲基戊烷 | C. | 2-甲基丁烷 | D. | 1,1-二甲基丙烷 |
9.实验室有几瓶标签脱落的无色液体:己烯、苯、四氯化碳、氢氧化钠溶液、苯酚溶液、碘化钾溶液,只用一种试剂即可鉴别,则该试剂可能是( )
| A. | 高锰酸钾 | B. | 氯化铁 | C. | 浓溴水 | D. | 水 |
16.在某一化学反应中,反应物B的浓度在5s内从2.0mol/L变成0.5mol/L,在这5s内B的化学反应速率为( )
| A. | 0.04 mol/L | B. | 0.3 mol/(L•s) | C. | 0.4 mol/(L•s) | D. | 0.3 |
13.下列关于有机物结构、性质的说法正确的是( )
| A. | 石油的分馏、裂化和煤的气化、液化、干馏都是化学变化 | |
| B. | 乙烯和苯都能与氢气发生加成反应,说明二者分子中所含碳碳键相同 | |
| C. | 甲烷、苯、乙醇、乙酸乙酯在一定条件下都能发生取代反应 | |
| D. | 蔗糖、油脂、蛋白质都能发生水解反应,都属于天然有机高分子化合物 |