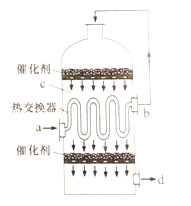
题目内容
【题目】在石蜡油的分解实验中,产物可使酸性高锰酸钾溶液褪色,也可以使溴的四氯化碳溶液褪色。
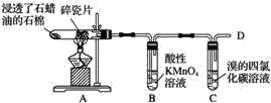
请你根据实验过程及现象探讨下列问题:
(1)碎瓷片的作用是__。
(2)分解产物中的气体是否都是烷烃__,你的依据是__。
(3)证明石蜡油分解产物中含有碳、氢元素的方法是__。
【答案】碎瓷片可起到催化剂的作用,促进石蜡油分解 产物中的气体一定不都是烷烃 因为烷烃是饱和烃,与甲烷性质相似,不能使酸性高锰酸钾溶液褪色,也不可能使溴的四氯化碳溶液褪色 在气体产物燃烧火焰的上方罩一干冷烧杯,若烧杯内壁有水珠,证明有氢元素;在火焰的上方罩一内壁附着澄清石灰水的烧杯,若出现浑浊现象,证明含有碳元素
【解析】
石蜡油在碎瓷片的催化作用下,分解的产物能使酸性高锰酸钾溶液和溴的四氯化碳溶液褪色,一定有不饱和烃(烯烃或乙烯)生成,据此分析解答。
(1)石蜡油分解较缓慢,加热碎瓷片能加快反应速率,碎瓷片还能吸收热量而积蓄热量从而促进石蜡油分解,起到催化剂作用;故答案为:碎瓷片可起到催化剂的作用,促进石蜡油分解;
(2)已知产物可使酸性高锰酸钾溶液褪色,也可以使溴的四氯化碳溶液褪色,则产物中的气体一定不都是烷烃,还有不饱和烃(烯烃或乙烯);故答案为:产物中的气体一定不都是烷烃;因为烷烃是饱和烃,与甲烷性质相似,不能使酸性高锰酸钾溶液褪色,也不可能使溴的四氯化碳溶液褪色;
(3)将气体产物点燃,并检验燃烧产物中有二氧化碳和水生成,故答案为:在气体产物燃烧火焰的上方罩一干冷烧杯,若烧杯内壁有水珠,证明有氢元素;在火焰的上方罩一内壁附着澄清石灰水的烧杯,若出现浑浊现象,证明含有碳元素。

 阅读快车系列答案
阅读快车系列答案【题目】下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
C | 在密闭容器中有反应:A+xB(g) | A为非气体、x=1 |
D | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
A. A B. B C. C D. D
【题目】下列表格中的各种情况,可以用对应选项中的图像表示的是
选项 | 反应 | 甲 | 乙 |
A | 外形、大小相近的金属和水反应 | Na | K |
B | 4mL0.01mol·L-1 KMnO4溶液分别和不同浓度的2mLH2C2O4(草酸)溶液反应 | 0.1mol·L-1的H2C2O4溶液 | 0.2mol·L-1的H2C2O4溶液 |
C | 5mL0.1mol·L-1Na2S2O3溶液和5mL0.1mol·L-1H2SO4溶液反应 | 热水 | 冷水 |
D | 5mL4%的过氧化氢溶液分解放出O2 | 无MnO2粉末 | 加MnO2粉末 |
A.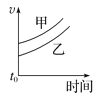 B.
B.
C. D.
D.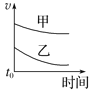
【题目】氮的氧化物既是空气的重要污染物,同时也是重要的化工原料。
(1)在373K时,向体积为2L的恒容真空容器中通入0.40molNO2,发生反应:2NO2(g)![]() N2O4(g) ΔH=57.0kJ·mol1。测得NO2的物质的量分数[φ(NO2)]与反应时间(t)的关系如下表:
N2O4(g) ΔH=57.0kJ·mol1。测得NO2的物质的量分数[φ(NO2)]与反应时间(t)的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 |
φ(NO2) | 1.0 | 0.75 | 0.52 | 0.40 | 0.40 |
①0~20 min内,υ(N2O4)=___mol·L1·min1。
②上述反应中,υ正(NO2)=k1·c2(NO2),υ逆(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为___。改变温度至T1时k1=k2,则T1__373K(填“>”“<”或“=”)。
(2)NH3催化还原氮氧化物是目前应用广泛的烟气脱硝技术。已知:6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(l) ΔH,向容积为2L的恒容密闭容器中,充入NO2和NH3的混合气体0.14mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如图中曲线所示[投料比=n(NO2)/n(NH3)]。
7N2(g)+12H2O(l) ΔH,向容积为2L的恒容密闭容器中,充入NO2和NH3的混合气体0.14mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如图中曲线所示[投料比=n(NO2)/n(NH3)]。
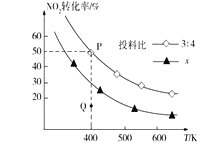
①ΔH___0(填“>”“<”或“=”)。
②x___3∶4(填“>”“<”或“=”)。
③400K时,反应的平衡常数为___(填计算式即可)。
④投料比为3∶4时,Q点υ逆(NH3)___(填“>”“<”或“=”)P点υ逆(NH3)。