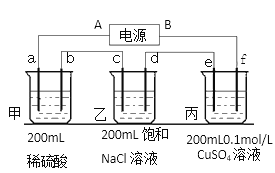
题目内容
【题目】现有A、B、C、D、E、F 原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3 个能级,且毎个能级所含的电子数相同;D的原子核外有8个运动状态不同的电子,E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)请写出D基态的价层电子排布图:_____。
(2)下列说法正确的是_____。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点SiO2>CO2
B.电负性顺序:C<N<O<F
C.N2与CO为等电子体,结构相似,化学性质相似
D.稳定性:H2O>H2S,原因是水分子间存在氢键
(3)某化合物与F(Ⅰ)(Ⅰ表示化合价为+1)结合形成如图所示的离子,该离子中碳原子的杂化方式是______。
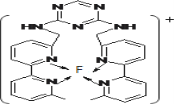
(4)己知(BC)2是直线性分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则(BC)2中σ键和π键的个数比为______。
(5)C元素最高价含氧酸与硫酸酸性强度相近,原因是______。
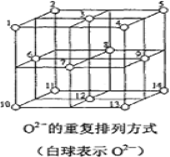
(6)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为_____,有_____%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a=______pm。(写出计算表达式)
【答案】![]() B sp 2、sp 3 3:4 HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近 2∶1 50%
B sp 2、sp 3 3:4 HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近 2∶1 50% ![]()
【解析】
A、B、C、D、E、F原子序数依次增大的六种元素,均位于元素周期表的前四周期,B元素含有3个能级,且每个能级所含的电子数相同,核外电子排布为1s22s22p2,故B为碳元素;D的原子核外有8个运动状态不同的电子,则D为O元素;C的原子序数介于碳、氧之间,故C为N元素;E元素与F元素处于同一周期相邻的族,它们的原序数相差3,二者只能处于第四周期,且E元素的基态原子有4个未成对电子,外围电子排布为3d64s2,则E为Fe,F为Cu,(3)中C(氮元素)与A形成的气体x,则A为H元素,形成的x为NH3,据此解答本题。
(1)(1)D为O元素,价电子排布为2s22p4,基态的价层电子排布图为:![]() ,
,
故答案为:![]() ;
;
(2)A、二氧化硅属于原子晶体,二氧化碳形成分子晶体,故点:SiO2>CO2,故A错误;
B、同周期自左而右电负性增大,电负性顺序:C<N<O<F,故B正确;
C、N2与CO为等电子体,氮气分子中N原子之间形成3对共用电子对,化学性质稳定,CO还原性较强,二者化学性质不同,故C错误;
D、水分子间存在氢键,影响物理性质,不影响化学性质,由于非金属性O>S,所以稳定性:H2O>H2S,故D错误,
故答案为:B;
(3)杂环上的碳原子含有3个σ键,没有孤对电子,采用sp2杂化,甲基、亚甲基上碳原子含有4个共价单键,采用sp3杂化,
故答案为:sp2、sp3;
(4)(CN)2是直线型分子,并有对称性,结构式为:N≡C-C≡N,单键为σ键,三键含有1个σ键、2个π键,(CN)2中σ键和π键的个数比为3:4,
故答案为:3:4;
(5)HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近,
故答案为:HNO3的非羟基氧个数与H2SO4的非羟基氧个数相同,所以酸性强度相近;
(6)结构中如1、3、6、7的O2围成的正四面体空隙有8个,由图可知晶体结构中O2离子数目为8×![]() +6×
+6×![]() =4个,则正四面体空隙数与O2离子数目之比为8:4=2:1;
=4个,则正四面体空隙数与O2离子数目之比为8:4=2:1;
Fe3O4中有一半的Fe3+填充到正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则有50%的正八面体空隙没有填充阳离子;
含有Fe3+和Fe2+的总数为3,晶胞中有8个图示结构单元,不妨取1mol这样的晶胞,则1mol晶胞的质量为m=8×(3×56+4×16)g=8×232g,1mol晶胞即有6.02×1023个晶胞,1个晶胞的体积为V=(a×1010)3cm3,所以晶体密度为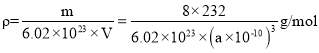 ,所以晶胞边长a=
,所以晶胞边长a=![]() pm,
pm,
故答案为:2:1;50;![]() 。
。

【题目】用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定过程中,眼睛应注视________________。滴定时,用0.2000molL-的盐酸来滴定待测液,不可选用______(填编号字母)作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定时,用0.200 0 mol·L-1的盐酸来滴定待测溶液,根据下表数据,计算被测烧碱溶液的物质的量浓度是________ mol·L-1,烧碱样品的纯度是________。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 4.10 | 24.00 |
(4)下列实验操作会对滴定结果产生什么后果?(填“偏高”、“偏低”或“无影响”)
①若将锥形瓶用待测液润洗,然后加入10.00mL待测液,则滴定结果______
②若锥形瓶未干燥就加入10.00mL待测液,则滴定结果______。