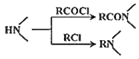
题目内容
【题目】已知化合物X由4种元素组成,某学习小组进行了如下实验:
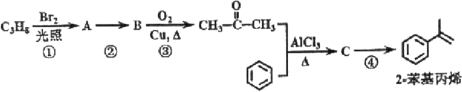
![]()
已知:步骤②中消耗KI0.15mol
请回答:
(1)X的化学式是___,黄色溶液乙与SO2反应的离子方程式是___。
(2)X中一种元素对应的单质,与足量的K2CO3溶液反应得到的产物中含溶液甲中溶质,写出该反应的化学方程式:___。
【答案】KIO32HIO3 I2+2H2O+SO2=2I-+SO42﹣+4H+ 3I2+2K2CO3+3H2O=5KI+KIO3+6KHCO3
【解析】
由反应②可知生成黄色溶液,则应生成碘,与二氧化硫发生氧化还原反应生成硫酸,方程式为I2+2H2O+SO2=2I﹣+SO42﹣+4H+,加入足量氯化钡生成硫酸钡沉淀质量为20.97g,可知n(BaSO4)=![]() ,则n(I2)=n(SO2)=0.09mol,n(I)=0.18mol,步骤②中消耗KI0.15mol,化合物X由4种元素组成,加入KOH为单一成分溶液,则应与KOH发生中和反应,含有K、H、I、O等元素,则5.66gX应含有n(I)=0.03mol,应发生IO3﹣+5I﹣+6H+=3I2+3H2O,消耗KI0.15mol,可知n(IO3﹣)=0.03mol,如化合物为0.01mol,则相对分子质量为
,则n(I2)=n(SO2)=0.09mol,n(I)=0.18mol,步骤②中消耗KI0.15mol,化合物X由4种元素组成,加入KOH为单一成分溶液,则应与KOH发生中和反应,含有K、H、I、O等元素,则5.66gX应含有n(I)=0.03mol,应发生IO3﹣+5I﹣+6H+=3I2+3H2O,消耗KI0.15mol,可知n(IO3﹣)=0.03mol,如化合物为0.01mol,则相对分子质量为![]() ,应为KIO32HIO3,以此解答该题。
,应为KIO32HIO3,以此解答该题。
(1)由以上分析可知X为KIO32HIO3,黄色溶液乙含有碘,与SO2反应的离子方程式是I2+2H2O+SO2=2I﹣+SO42﹣+4H+,故答案为:KIO32HIO3;I2+2H2O+SO2=2I﹣+SO42﹣+4H+;
(2)X中一种元素对应的单质,与足量的K2CO3溶液反应得到的产物中含溶液甲中溶质,应为碘与碳酸钾的反应,化学方程式为3I2+2K2CO3+3H2O=5KI+KIO3+6KHCO3,故答案为:3I2+2K2CO3+3H2O=5KI+KIO3+6KHCO3。

【题目】(1)某温度下,纯水中的c(H+)=2.0×10-7mol·L-1,则此时溶液的c(OH-)=________ mol·L-1;若温度不变,滴入稀盐酸使c(H+)=5.0×10-6 mol·L-1,则c(OH-)=_________ mol·L-1。
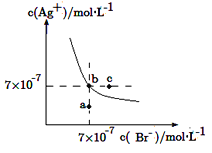
(2)在2mL 0.1mol·L-1的NaCl溶液中,加入2mL 0.1mol·L-1的AgNO3溶液,可观察到白色沉淀生成。将此混合液过滤,向滤渣中加入2mL 0.1mol·L-1的KI溶液,搅拌,可观察到_______________, 反应的离子方程式为______________________。
(3)下列说法不正确的是_____________。
A.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
B.所有物质的溶解都是吸热的
C.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全
D.除去溶液中的Mg2+,用OH-沉淀Mg2+比![]() 用效果好,说明 Mg(OH)2的溶解度比MgCO3大
用效果好,说明 Mg(OH)2的溶解度比MgCO3大
(4)25 ℃,两种常见酸的电离常数如下表所示。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①![]() 的电离常数表达式 K =_____________。
的电离常数表达式 K =_____________。
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为______________。