题目内容
(11分)2010年春至2013年连续四年发生在云南省的严重旱情牵动了全国人民的心,引起人们对水资源的再次重视。水是组成生命体的重要化学物质,有关水的反应有很多。
(1)用电子式表示H2O的形成过程 。
(2)在pH=1的水溶液中,①NH4+、Al3+、Br-、SO42- ② Na+、Fe2+、Cl-、NO3-
③K+、Ba2+、Cl-、NO3- ④K+、Na+、HCO3-、SO42-四组离子中,一定大量共存的是 (填序号)。
(3)在下列反应中,水仅做氧化剂的是 (填字母,下同),水既不做氧化剂又不做还原剂的是 。
| A.2F2+2H2O=4HF+O2 | B.2Na2O2+2H2O=4NaOH+O2↑ |
| C.CaH2+2H2O=Ca(OH)2+2H2↑ | D.3Fe+4H2O Fe3O4+4H2 Fe3O4+4H2 |
(1)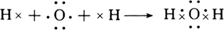 (2分)
(2分)
(2)①③ (2分) (3)CD (2分) B(1分)
(4)H2+2OH?—2e?=2H2O (2分) 200NA(2分)
解析试题分析:(1)H2O为共价化合物,各原子达到稳定结构,用电子式表示形成过程为: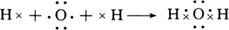
(2)①pH=1的溶液呈酸性,各离子互不反应,可以大量共存;②酸性溶液中,NO3?、H+与Fe2+发生氧化还原反应,不能大量共存;③各离子互不反应,可以大量共存;④HCO3?与H+反应,不能大量共存。
(3)A、2F2+2H2O=4HF+O2, 依据化合价变化,水中O元素化合价升高,水做还原剂;B、2Na2O2+2H2O=4NaOH+O2↑,据化合价变化,此反应是过氧化钠的自身氧化还原反应,水既不是氧化剂也不是还原剂;C、CaH2+2H2O=Ca(OH)2+2H2↑,依据化合价变化,水中的氢元素化合价降低,水做氧化剂;D、3Fe+4H2O(g) Fe3O4+4H2,依据化合价的变化,水中的氢元素化合价降低,水做氧化剂;所以水仅做氧化剂的是CD,水既不做氧化剂又不做还原剂的是B。
Fe3O4+4H2,依据化合价的变化,水中的氢元素化合价降低,水做氧化剂;所以水仅做氧化剂的是CD,水既不做氧化剂又不做还原剂的是B。
(4)负极上H2失去电子,电极方程式为:H2+2OH?—2e?=2H2O;H2O的密度约为100g/L,所以1.8 L H2O的物质的量为:1800g÷18g/mol=100mol,根据电池总反应2H2+O2=2H2O可得对应关系:H2O ~ 2e?,所以电子转移为200mol,数目为200NA。
考点:本题考查电子式、离子共存、氧化还原反应原理、原电池原理。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案下列溶液中,各组离子一定能大量共存的是
| A.能使石蕊试液呈蓝色的溶液:Na+、I-、Cl-、NO3- |
| B.含大量Fe3+的溶液:NH4+、Na+、Cl-、SCN- |
| C.能与Al反应生成H2的溶液:Ca2+、NH4+、HCO3-、Cl- |
| D.水电离出的c(H+)=1×10-14mol/L的溶液:K+、AlO2-、Br-、Cl- |
一定能在下列溶液中共存的离子组是( )
| A.加入铝粉有气体放出的溶液中:Na+、NH4+、NO3-、Cl- |
| B.加入NaOH溶液后加热既有气体放出又有沉淀生成的溶液中:Mg2+、NH4+、SO42-、Na+ |
| C.pH=0.3的溶液中:Na+、Al3+、SO42-、CO32- |
| D.存在较多H+、SO42-、NO3-的溶液中:Al3+、CH3COO-、Cl-、K+ |
下列离子方程式书写正确的是
| A.硫氢化钠的水解:HS-+H2O === S2-+H3O+ |
| B.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=== Fe3++3H2O |
| C.钢铁发生吸氧腐蚀的负极反应式:O2+4e-+2H2O === 4OH- |
| D.碳酸氢铵溶液中滴入少量烧碱溶液:HCO3-+OH-=== CO32-+H2O |
(14分)Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si S | O2- Na+ | NaCl Si | H2SO4 HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101KPa下,已知该反应每消耗1 mol CuCl2(s),放热44.4KJ,该反应的热化学方程式是 。
(4)ClO2是常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目 。
(16分)卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁。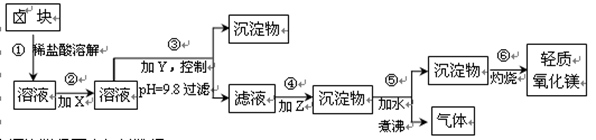
查阅资料得下表相关数据:
| 表1: 生成氢氧化物沉淀的pH | 表2: 原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的 (选填试剂编号)。
(2)步骤②发生反应的离子方程式为 ;步骤⑤中发生反应的化学方程为 。
(3)步骤③控制pH=9.8的目的是 。
(4) 若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、 和
泥三角。
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原
因 。
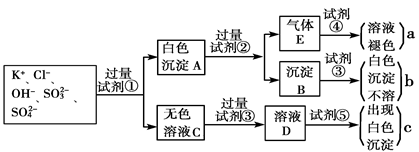
 溶液,当Al3+恰好全部沉淀时:
溶液,当Al3+恰好全部沉淀时: