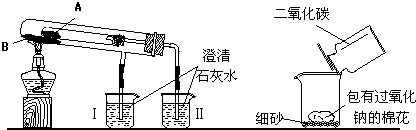
题目内容
3.为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580mL(标准状况);
方案二:将a g铁片完全溶解于过量稀硫酸中,并配制成250mL溶液,从中取出25.00mL于锥形瓶中,用0.02000mol•L-1的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液.
请回答下列问题:
(1)配平下面的化学方程式(将有关的化学计量数填入答题卡的横线上):
□KMnO4+□FeSO4+□H2SO4=□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
(2)取用FeSO4溶液时,需要用到仪器是酸式滴定管
(3)用KMnO4溶液进行滴定时,可选用指示剂是不需要指示剂(如果你认为不需要指示剂,该空可以不填),判断KMnO4与FeSO4恰好反应的依据是加入最后一滴KMnO4溶液,KMnO4溶液紫色不再褪去,且半分钟颜色不变;
(4)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为$\frac{1.45}{a}$和$\frac{1.40}{a}$.
分析 (1)根据氧化还原反应得失电子数目相等结合质量守恒定律配平;
(2)橡胶可以被酸性物质和强氧化性物质腐蚀;
(3)滴定时,加入最后一滴KMnO4溶液,KMnO4溶液紫色不再褪去,且半分钟颜色不变,说明滴定到终点,据此分析;
(4)根据方案一:Fe+H2SO4=FeSO4+H2↑,方案二:Fe+H2SO4=FeSO4+H2↑,2KMnO4+10FeSO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O反应的化学方程式计算.
解答 解:(1)元素的化合价变化为:Mn:+7→+2,改变数为5,Fe:+2→+3,改变数为1,根据化合价升降的总数相等可知,
KMnO4与FeSO4的化学计量数比值为1:5,然后根据质量守恒配平化学方程式,配平后的化学方程式为
2KMnO4+10FeSO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O,
故答案为:2,10,8,5,2,1,8;
(2)根据橡胶的性质,可以被酸性物质和强氧化性物质腐蚀,所以取用FeSO4溶液时,需要用到仪器是酸式滴定管,
故答案为:酸式滴定管;
(3)滴定时,加入最后一滴KMnO4溶液,KMnO4溶液紫色不再褪去,且半分钟颜色不变,说明滴定到终点,所以不需要用指示剂,KMnO4与FeSO4恰好反应的依据是加入最后一滴KMnO4溶液,KMnO4溶液紫色不再褪去,且半分钟颜色不变,
故答案为:不需要指示剂;加入最后一滴KMnO4溶液,KMnO4溶液紫色不再褪去,且半分钟颜色不变;
(4)方案一:Fe+H2SO4=FeSO4+H2↑,n(H2)=n(Fe)=$\frac{580}{22400}$mol,
m(Fe)=$\frac{580}{22400}$mol×56g/mol=1.45g,质量分数w(Fe)$\frac{1.45}{a}$;
方案二:
Fe+H2SO4=FeSO4+H2↑,2KMnO4+10FeSO4+8H2SO4=5Fe2(SO4)3+2MnSO4+K2SO4+8H2O
n(Fe)=n(FeSO4)=5n(KMnO4)=5×0.02000mol•L-1×0.025L×$\frac{250}{25}$=0.025mol;
m(Fe)=56×0.025g=1.40g,质量分数w(Fe)=$\frac{1.40}{a}$;
故答案为:$\frac{1.45}{a}$; $\frac{1.40}{a}$.
点评 本题考查物质的组成和含量的测量,题目较为综合,难度较大,注意把握实验方案的设计原理.本题易错点为(4).

| A. | 两原子,如果核外电子数相同,则一定属于同种元素 | |
| B. | 两种微粒,若核外电子数相同,则其化学性质一定相同 | |
| C. | 在多电子的原子里不同电子层的核外电子的能量是不相同的 | |
| D. | 能量低的电子在离核近的区域运动 |
| A. | CH3COOH+C2H5OH→CH3COOCH2CH3+H2O 取代反应 | |
| B. | CH2=CH2+O2→CH3COOH 加成反应 | |
| C. | CH3CH2OH+CH3CH2OH→CH3CH2OCH2CH3+H2O 酯化反应 | |
| D. | C6H6+HNO3→C6H5-NO2+H2O 氧化反应 |
| A. | 0.2mol•L-1 | B. | 0.25mol•L-1 | C. | 0.45mol•L-1 | D. | 0.225mol•L-1 |
| A. | 工业制取金属钾:Na(l)+KCl(l)?NaCl(l)+K(g)选取适宜的温度,使K成蒸汽从反应混合物中分离出来 | |
| B. | 配制氯化铁溶液时,将氯化铁加入盐酸中,然后加水稀释 | |
| C. | 向氯水中加CaCO3后,溶液漂白性增强 | |
| D. | 二氧化氮与四氧化二氮的平衡体系,加压缩小体积后颜色加深 |
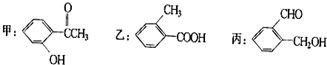 今有化合物:
今有化合物: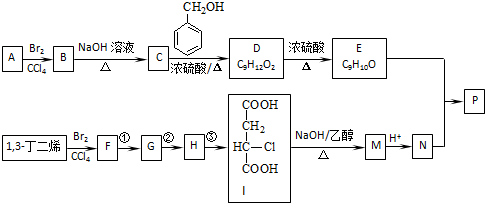
 (R1~R4表示氢或烃基)
(R1~R4表示氢或烃基)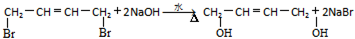 .
.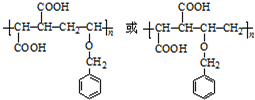 .
.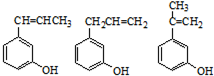 (其中任一种).
(其中任一种).