题目内容
【题目】Ⅰ.已知五种元素的原子序数的大小顺序为 C>A>B>D>E,A、C同周期,B、C 同主族;A与B形成离子化合物,![]() 中所有的离子的电子数相同, 其电子总数为 30;D 和 E 可形成 5核10电子的分子。试回答下列问题:
中所有的离子的电子数相同, 其电子总数为 30;D 和 E 可形成 5核10电子的分子。试回答下列问题:
(1)写出下列物质的电子式:
![]() 的电子式:____________________;A、B、E形成的化合物:____________________;
的电子式:____________________;A、B、E形成的化合物:____________________;
(2)A、B 两元素组成的化合物![]() 存在的化学键是__________________________________。
存在的化学键是__________________________________。
(3)写出 D 和 E 形成的 5 核 10 电子分子与氯气的第一步反应的方程式:___________________________________________________。
Ⅱ.对下列物质进行分类(均填序号)。互为同素异形体的是________________;互为同分异构体的是________________;互为同系物的是________________.
①![]() 和
和![]() ;②
;②![]() 与
与![]() ;③
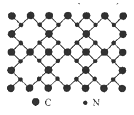
;③![]() 和
和![]() ;④金刚石与水晶; ⑤正戊烷和异戊烷 ⑥
;④金刚石与水晶; ⑤正戊烷和异戊烷 ⑥![]() 和
和 ![]() ⑦
⑦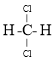
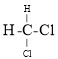 ;⑧
;⑧![]() 与
与![]()
【答案】![]()
![]() 离子键、共价键
离子键、共价键 ![]() ②③ ⑤ ⑥
②③ ⑤ ⑥
【解析】
Ⅰ.A2B中A、B离子的电子数相同,电子总数为30,则每个A、B离子的电子数为10,可推出A是Na,B是O;
又因为D和E可形成5核10电子分子,只能是CH4,原子序数D>E,故D是C,E是H;
C与A(Na)同周期,与B(O)同主族,所以C位于第三周期ⅥA族,是S;
综上所述,A、B、C、D、E分别为:Na、O、S、C、H,据此回答
Ⅰ.(1)D为C,E为H,所以,D2E4 (C2H4)的电子式为:![]() ,A(Na)、B(O)、E(H)形成的化合物为NaOH,其电子式为:
,A(Na)、B(O)、E(H)形成的化合物为NaOH,其电子式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)A2B2(Na2O2)既含离子键,又含共价键,故答案为:离子键、共价键;
(3)由分析可知,5核10电子分子为CH4,CH4与氯气在光照条件下共涉及4个取代反应,第一步反应的方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
Ⅱ.由同种元素组成的不同单质互为同素异形体,故互为同素异形体的为:②③;分子式相同,结构式不同的化合物互为同分异构体,故互为同分异构体的为:⑤;组成相同,结构相似,分子中相差若干个CH2原子团的化合物互为同系物,故互为同系物的为:⑥,故答案为:②③;⑤;⑥。