题目内容
11.下列各组离子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )| 选项 | 离子组 | 所加试剂 | 离子方程式 |
| A | Mg2+、Fe3+、NO3- | KSCN溶液 | Fe3++3SCN-═Fe(SCN)3↓ |
| B | NH4+、HCO3-、Cl- | 过量NaOH溶液 | HCO3-+OH-═CO32-+H2O |
| C | Fe2+、Cl-、H+ | KNO3溶液 | 3Fe2++NO3-+4H+═NO↑+2H2O+3Fe3+ |
| D | K+、H+、C6H5O- | Na2CO3溶液 | 2H++CO32-═CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Fe(SCN)3溶于水;
B.加入过量氢氧化钠生成CO32-和一水合氨;
C.离子之间不发生反应,加入硝酸钾,硝酸根离子与亚铁离子发生氧化还原反应;
D.H+、C6H5O-不能大量共存.
解答 解:A.Fe(SCN)3溶于水,离子方程式为Fe3++3SCN-═Fe(SCN)3,故A错误;
B.该组离子之间不反应,可大量共存,加NaOH溶液,发生NH4++HCO3-+2OH-═CO32-+NH3.H2O+H2O,故B错误;
C.离子之间不发生反应,加入硝酸钾,硝酸根离子与亚铁离子发生氧化还原反应,离子方程式为3Fe2++NO3-+4H+═NO↑+2H2O+3Fe3+,故C正确;
D.H+、C6H5O-不能大量共存,故D错误.
故选C.
点评 本题考查离子反应的书写及离子共存,为高频考点,把握离子的性质及常见离子之间的反应为解答的关键,侧重氧化还原反应及水解反应、复分解反应的离子反应考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.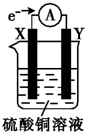 将用导线连接的电极X、Y插入装有硫酸铜溶液的烧杯中(外电路中电子流向如图所示).据此判断下列说法正确的是( )
将用导线连接的电极X、Y插入装有硫酸铜溶液的烧杯中(外电路中电子流向如图所示).据此判断下列说法正确的是( )
 将用导线连接的电极X、Y插入装有硫酸铜溶液的烧杯中(外电路中电子流向如图所示).据此判断下列说法正确的是( )
将用导线连接的电极X、Y插入装有硫酸铜溶液的烧杯中(外电路中电子流向如图所示).据此判断下列说法正确的是( )| A. | 外电路中电流方向为X→Y | |
| B. | 若电极材料分别为锌片和铜片,则Y为锌片 | |
| C. | X极上发生还原反应 | |
| D. | 若电极材料都是金属,则金属活动性:X>Y |
19.下列关于钠的叙述错误的是( )
| A. | 实验后剩余的钠粒可放回原试剂瓶中 | |
| B. | 刚刚切开的钠的银白色断面会很快变暗 | |
| C. | 自然界中无游离态的钠存在 | |
| D. | 钠在空气中加热时生成白色的过氧化钠 |
6.在(NH4)2Fe(SO4)2溶液中逐滴加入100mL 1mol/L的Ba(OH)2溶液,把所得沉淀过滤、洗涤、干燥,得到的固体质量不可能是( )
| A. | 35.3g | B. | 33.5g | C. | 32.3g | D. | 11.3g |
3.下列化学变化中,不能够通过一步反应实现的是( )
| A. | Na→Na2O2 | B. | N2→NH3 | C. | N2→NO2 | D. | Ca(OH)2→NaOH |
1.NA为阿伏加德罗常数,下述正确的是( )
| A. | 58.5g氯化钠晶体中含有NA个氯化钠分子 | |
| B. | 20g重水(D2O)中含有的电子数为10NA | |
| C. | 标准状况下,22.4L CCI4含有NA个CCI4分子 | |
| D. | 120g NaHSO4晶体中阳离子和阴离子的总数为3NA |
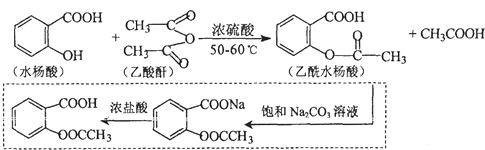
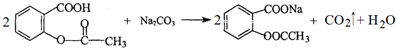
 .
.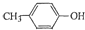 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: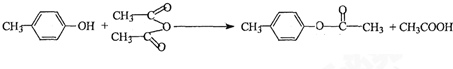 .
.