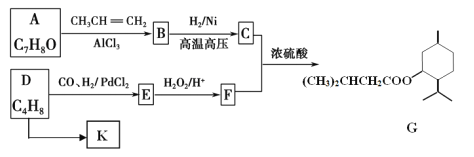
题目内容
【题目】固体X只可能由Al、(NH4)2SO4、MgCl2、FeCl2、AlCl3中的一种或几种组成,某同学对该固体进行了如下实验:
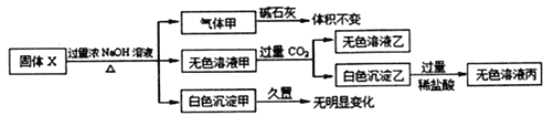
(1)若气体甲通过浓硫酸后体积减小,但还有剩余,则原混合物中一定存在的物质是___________,可能存在的物质是________________
(2)无色溶液甲通入过量的CO2,反应的离子方程式为________________________;
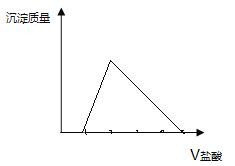
(3)在下图上画出无色溶液甲中逐滴滴加盐酸,生成白色沉淀与滴加盐酸的量关系示意图. ________________
【答案】 Al、(NH4)2SO4 、MgCl2 AlCl3 OH-+ CO2= HCO3- [Al(OH)4]–+CO2=Al(OH)3↓+HCO3- 略。至少要体现2点:一是一开始加盐酸没有沉淀,二是生成最大值沉淀与沉淀消失所用盐酸体积为1:3
【解析】根据图像可知,固体X在过量浓NaOH溶液中加热后产生白色沉淀甲,甲久置无明显变化,证明沉淀为氢氧化镁,不含氢氧化亚铁,固体X中一定含有MgCl2,一定不含FeCl2,无色溶液甲通入过量CO2产生白色沉淀乙为氢氧化铝,说明溶液甲中含有NaAlO2,但NaAlO2也可能是由铝与氢氧化钠反应得到的,不能说明原溶液中一定含有AlCl3,无色溶液乙为碳酸氢钠溶液,白色沉淀乙与过量稀盐酸反应生成无色溶液丙为氯化铝,Al与氢氧化钠溶液反应产生氢气,(NH4)2SO4在氢氧化钠浓溶液加热条件下反应生成氨气,故气体甲可能是氢气、氨气中的一种或两种。
(1)若气体甲通过浓硫酸后体积减小,但还有剩余,则气体为氢气和氨气的混合物质,综上,原混合物中一定存在的物质是Al、(NH4)2SO4、MgCl2,可能存在的物质是AlCl3;(2)无色溶液甲(Na[Al(OH)4])通入过量的CO2生成Al(OH)3沉淀和NaHCO3,其反应的离子方程式为: [Al(OH)4]–+CO2=Al(OH)3↓+HCO3-;(3)无色溶液甲是过量的氢氧化钠和偏铝酸钠溶液的混合物,逐滴滴加盐酸,开始加盐酸与氢氧化钠反应没有沉淀,氢氧化钠消耗完后,加入的盐酸与偏铝酸钠反应产生氢氧化铝沉淀,偏铝酸钠反应完后,盐酸开始溶解氢氧化铝使沉淀溶解,且生成最大值沉淀与沉淀消失所用盐酸体积为1:3,示意图为:

【题目】某溶液中,若忽略水的电离,只含有下表中所示的四种离子,.则表中X离子种类及其个数b为
离子种类 | Na+ | Al3+ | Cl- | X |
个数 | 2a | a | a | b |
A. NH4+、4a B. SO42-、2a C. OH-、4a D. CO32-、2a