题目内容
【题目】A、B、C、D、E是核电荷数递增的5种短周期元素,原子半径按D、E、B、C、A递减,B、E同主族,则下列推断正确的是( )
A. A、B、E-定处于三个不同的短周期
B. A、D不可能在同一主族
C. C的最高价氧化物对应的水化物可能显碱性
D. C和D的单质不可能化合成1:1型离子化合物
【答案】A
【解析】A、B、C、D、E是核电荷数递增的5种短周期元素,原子半径按D、E、B、C、A递减,B、E同主族,推出在元素周期表大概的位置为 ,A、根据在元素周期表大概的位置,A、B、E一定处于三个不同的短周期,故A正确;B、A和D可能位于同一主族,故B错误;C、如果A和D位于同一主族,则C一定为非金属单质,其最高价氧化物的水化物显酸性,故C错误;D、假设D为Na,C为F,形成NaF的离子化合物,故D错误。
,A、根据在元素周期表大概的位置,A、B、E一定处于三个不同的短周期,故A正确;B、A和D可能位于同一主族,故B错误;C、如果A和D位于同一主族,则C一定为非金属单质,其最高价氧化物的水化物显酸性,故C错误;D、假设D为Na,C为F,形成NaF的离子化合物,故D错误。

【题目】Ⅰ.制备水杨酸对正辛基苯基酯(![]() )的过程如下:
)的过程如下:
步骤一:将水杨酸晶体投入到三颈烧瓶中,再加入适量的氯苯作溶剂并充分搅拌使晶体完全溶解,最后加入少量的无水三氯化铝。
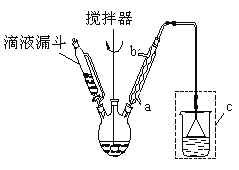
步骤二:按下图所示装置装配好仪器,水浴加热控制温度在20~40℃之间,在搅拌下滴加SOCl2,反应制得水杨酰氯。
该反应方程式为:
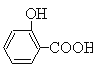 (水杨酸)+SOCl2→
(水杨酸)+SOCl2→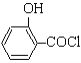 (水杨酰氯)+HCl↑+SO2↑
(水杨酰氯)+HCl↑+SO2↑
步骤三:将三颈烧瓶中混合液升温至80℃,再加入对正辛苯酚[![]() ],温度控制在100℃左右,不断搅拌。
],温度控制在100℃左右,不断搅拌。
步骤四:过滤、蒸馏、减压过滤;酒精洗涤、干燥即得产品。
(1)实验时,冷凝管中的冷却水进口为 _______(选填“a”或“b”);
(2)步骤一中加入无水三氯化铝的作用是 ___________________________。
(3)步骤三中发生反应的化学方程式为 _____________________________。
Ⅱ.PCl3可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其他 | |
白磷 | 44.1 | 280.5 | 1.82 | 2P(过量)+3Cl2 |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 1.675 | 遇水生成H3PO4和HCl,能溶于PCl3 |
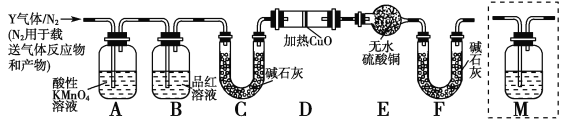
已知下图是实验室制备PCl3的装置(部分仪器已省略),则:
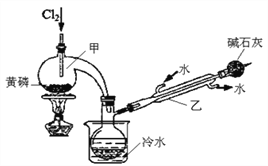
(1)实室制备Cl2的离子反应方程式为:________________。
(2)碱石灰的作用除了防止空气中的O2和水蒸气进入并与产品发生反应外还有:_________。
(3)向仪器甲中通入干燥Cl2之前,应先通入一段时间的干燥CO2,其目的是_____________。
(4)测定产品中PCl3纯度的方法如下:迅速称取m g产品,水解完全后配成500mL溶液,取出25.00mL加入过量的c1 mol/L V1 mL 碘溶液,充分反应后再用c2 mol/L Na2S2O3溶液滴定过量的碘,终点时消耗V2 mL Na2S2O3溶液。已知:H3PO3+H2O+I2==H3PO4+2HI;I2+2Na2S2O3==2NaI+Na2S4O6;假设测定过程中没有其他反应,则根据上述数据,求出该产品中PCl3的质量分数为 ___________________(用含字母的代数式表示、可不化简)。
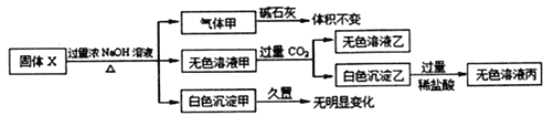
【题目】软锰矿的主要成分为MnO2,含少量Al2O3和SiO2。闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。现以软锰矿和闪锌矿为原料制备MnO2和Zn,其简化流程如下(中间产物的固体部分已经略去)。

已知: Ⅰ.矿石中所有金属元素在滤液A中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中为了加快硫酸的浸取速率,可采用的方法是_________________(任写一种)。①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式______________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_________。
(3)步骤③中MnO2的其作用是__________________,另外一种物质X可以是__________。
A.ZnO B.MgCO3 C.MnCO3 D.Cu(OH)2
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为: Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式__________。
(5)已知:HCN的电离常数K=4.9×10-10,H2S的电离常数K1=1.3×10―7,K2=7.0×10―15,向NaCN溶液中通入少量的H2S气体,反应的离子方程式为__________________。在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020 mol·L―1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS―浓度为1.0×10―4 mol·L―1时,Mn2+开始沉淀,则a=______。[已知:Ksp(MnS)=1.4×10―15]