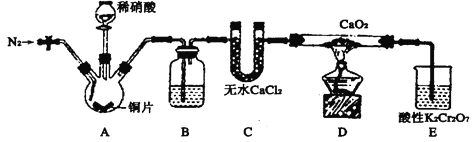
题目内容
【题目】下列说法错误的是( )
A.金属铁原子核外电子运动状态有26种
B.金刚石晶胞中原子的体积占晶胞体积的百分率表达式为![]() π×100%
π×100%
C.从原子轨道重叠方式考虑,氮气分子中的共价键类型有σ键和π键
D.HCN分子的空间构型为直线形
【答案】B
【解析】
A.基态Fe原子核外有26个电子,则有26种运动状态,故A正确;
B.碳原子与周围4个相邻的碳原子形成正四面体,顶点碳原子与正四面体中心碳原子连线处于体对角线上,且二者距离等于体对角线长度的![]() ,而体对角线长度等于晶胞棱长的
,而体对角线长度等于晶胞棱长的![]() 倍,若晶胞参数为apm,则碳原子半径=a pm×
倍,若晶胞参数为apm,则碳原子半径=a pm×![]() ×
×![]() =
=![]() pm,晶胞中碳原子数目=4+8×
pm,晶胞中碳原子数目=4+8×![]() +6×
+6×![]() =8,晶胞中碳原子总体积=8×
=8,晶胞中碳原子总体积=8×![]() π(
π(![]() )3,晶胞体积为a3,碳原子在晶胞中的空间占有率=
)3,晶胞体积为a3,碳原子在晶胞中的空间占有率=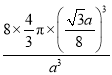 ×100%=
×100%=![]() ×100%,故B错误;
×100%,故B错误;
C.N2分子中存在氮氮叁键,其中含有1个σ键和2个π键,故C正确;
D.HCN分子中C原子的杂化轨道形式是sp杂化,则HCN的空间构型为直线形,故D正确;
故答案为B。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)配制待测液,用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液。除烧杯、量筒和胶头滴管外,还需要的玻璃仪器有__________、__________。
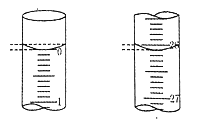
(2)滴定:用标准的盐酸溶液滴定待测的氢氧化钠溶液时,达到滴定终点的判断依据是:__________,若滴定开始和结束时,酸式滴定管中的液面如图所示,则终点读数_________mL。
(3)数据处理,某学生根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.31 |
则该氢氧化钠溶液的物质的量浓度c(NaOH)=___________。(保留三位有效数字)
(4)若改用含Na2O杂质的NaOH配制成标准溶液来滴定盐酸,测得的盐酸浓度将________。(选填“偏高”、“偏低”或“无影响”)