题目内容
【题目】研究氮氧化物的反应机理,对于消除其对环境的污染有重要意义。
(1)升高温度,绝大多数的化学反应速率增大,但是2NO(g)+O2(g) ![]() 2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g)
2NO2(g)的反应速率却随着温度的升高而减小。查阅资料知:2NO(g)+O2(g) ![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
I.2NO(g) ![]() N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
N2O2(g)(快) △H1<0 v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
Ⅱ.N2O2(g)+O2(g) ![]() 2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
2NO2(g)(慢) △H2<0 v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
请回答下列问题:
①反应2NO(g)+O2(g) ![]() 2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)
2NO2(g)的△H=___________(用含△H1和△H2的式子表示)。一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
2NO2(g)达到平衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=___________,升高温度,K值___________(填“增大”“减小”或“不变”)
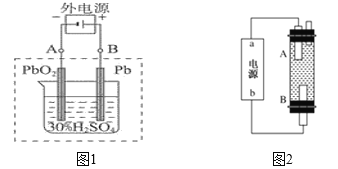
②决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
2NO2(g)反应速率的是反应Ⅱ,反应I的活化能E1与反应Ⅱ的活化能E2的大小关系为E1___________E2(填“>”“<”或“=”)。由实验数据得到v2正~c(O2)的关系可用图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
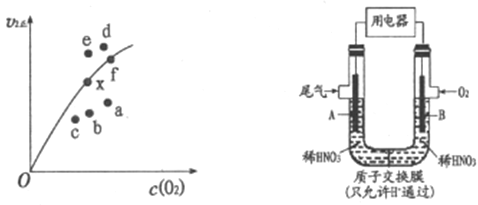
(2)通过图所示装置,可将汽车尾气中的NO、NO2转化为重要的化工原料HNO3,其中A、B为多孔惰性电极。该装置的负极是__________ (填“A”或“B”),B电极的电极反应式为__________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1L溶液甲,溶液乙为0.1mol/L的CH3COONa溶液,则两溶液中c(NO3-)、c (NO2-)和c(CH3COO-)由大到小的顺序为__________(已知HNO2的电离常数Kα=7.1×10-4mol/L,CH3COOH的电离常数Kα=1.7×10-5mol/L)。可使溶液甲和溶液乙的pH相等的方法是__________。
a.向溶液甲中加适量水 b.向溶液甲中加适量NaOH
c.向溶液乙中加适量水 d.向溶液乙中加适量NaOH
【答案】△H1+△H2 ![]() 减小 < a A O2+4e-+4H+=2H2O c(NO3-)>c(NO2-)>c(CH3COO-) bc
减小 < a A O2+4e-+4H+=2H2O c(NO3-)>c(NO2-)>c(CH3COO-) bc
【解析】
(1)①运用盖斯定律,将方程式叠加,就可以得到相应反应的热化学方程式;根据反应达到平衡时正、逆反应速率相等,结合速率与物质浓度关系,可得K的表达式;再利用温度对化学平衡的影响,分析温度与化学平衡常数的关系;②根据活化能高反应速率慢,活化能低化学反应速率快,比较二者活化能的大小;然后利用温度对化学平衡移动的影响,结合物质浓度的变化,确定物质的位置;(2)根据负极失去电子,发生氧化反应物质所含元素的化合价升高;正极得到电子,发生还原反应进行分析判断;(3)利用物质之间的反应,确定溶液的成分,结合元素守恒、结合盐的水解规律比较离子浓度的大小;并根据影响溶液pH的因素选择合适的方法,调节溶液的pH,据此解答。
(1) I .2NO(g)![]() N2O2(g) △H1<0;II.N2O2(g)+O2(g)
N2O2(g) △H1<0;II.N2O2(g)+O2(g)![]() 2NO2(g) △H2<0,I+II可得:2NO(g) +O2(g)
2NO2(g) △H2<0,I+II可得:2NO(g) +O2(g)![]() 2NO2(g) △H=△H1+△H2,当该反应达到平衡时,V1正=V1逆,V2正=V2逆,所以V1正×V2正=V1逆×V2逆,即k1正c2(NO)×K2正c(N2O2)×c(O2)= k1逆c(N2O2)×K2逆c2(NO2)×c(O2),则是K=
2NO2(g) △H=△H1+△H2,当该反应达到平衡时,V1正=V1逆,V2正=V2逆,所以V1正×V2正=V1逆×V2逆,即k1正c2(NO)×K2正c(N2O2)×c(O2)= k1逆c(N2O2)×K2逆c2(NO2)×c(O2),则是K=![]() =
=![]() ;由于该反应的正反应为放热反应,所以升高温度,平衡向吸热的逆反应方向移动,使化学反应平衡常数减小;②2NO(g) +O2(g)
;由于该反应的正反应为放热反应,所以升高温度,平衡向吸热的逆反应方向移动,使化学反应平衡常数减小;②2NO(g) +O2(g)![]() 2NO2(g)反应的快慢由反应速率慢的反应II决定,所以反应的活化能E1<E2,温度升高,K2正增大,反应速率加快,c(NO2)减小,导致两者的积减小;V2正升高到某一温度时V2正减小,平衡向逆反应方向移动,c(O2)增大,因此反应重新达到平衡,则变为相应的点为a;
2NO2(g)反应的快慢由反应速率慢的反应II决定,所以反应的活化能E1<E2,温度升高,K2正增大,反应速率加快,c(NO2)减小,导致两者的积减小;V2正升高到某一温度时V2正减小,平衡向逆反应方向移动,c(O2)增大,因此反应重新达到平衡,则变为相应的点为a;
(2)A电极通入NO、NO2,N元素的化合价升高,失去电子,发生氧化反应产生HNO3,因此该电极为负极,通入O2的电极为正极,获得电子,发生还原反应,由于是酸性环境,所以该电极的反应式为O2+4e-+4H+=2H2O;
(3)实验室可用NaOH溶液吸收NO2,反应方程式为2NO2+2NaOH=NaNO3+NaNO2+H2O。若NaOH、NO2的物质的量都是0.2 mol,则根据反应方程式可知会产生0.1mol NaNO3和0.1molNaNO2;由于溶液的体积是1L,c(NO2-)=0.1mol/L,c(NO3-)=0.1mol/L 。NaNO3是强酸强碱盐,不水解,则c(NO3-)=0.1mol/L;而NaNO2是强碱弱酸盐,NO2-发生水解反应而消耗,所以c(NO2-)<0.1mol/L;溶液乙为0.1mol/L的CH3COONa,该盐是强碱弱酸盐,CH3COO-水解消耗,因此n(CH3COO-)<0.1mol;根据HNO2、CH3COOH的电离平衡常数可知酸性:HNO2>CH3COOH,所以水解程度:CH3COO->NO2-,因此等浓度的CH3COONa、NaNO2中离子浓度c(CH3COO-)< c(NO2-),故三种离子浓度由大到小的顺序是:c(NO3-)>c(NO2-)>c(CH3COO-);溶液甲是NaNO3和NaNO2的混合溶液,NaNO2水解使溶液显碱性,溶液乙为CH3COONa溶液,水溶液显碱性,由于CH3COONa水解程度大于NaNO2,所以碱性乙>甲,要使溶液甲和溶液乙的pH相等,可采用向甲溶液中加入适量的碱NaOH,使溶液的pH增大,也可以向乙溶液中加入适量的水进行稀释,使乙的pH减小,故合理选项是bc。