题目内容
【题目】某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)配制待测液,用5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液。除烧杯、量筒和胶头滴管外,还需要的玻璃仪器有__________、__________。
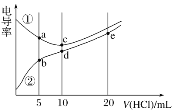
(2)滴定:用标准的盐酸溶液滴定待测的氢氧化钠溶液时,达到滴定终点的判断依据是:__________,若滴定开始和结束时,酸式滴定管中的液面如图所示,则终点读数_________mL。
(3)数据处理,某学生根据三次实验分别记录有关数据如下:
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 |
第三次 | 25.00 | 0.22 | 26.31 |
则该氢氧化钠溶液的物质的量浓度c(NaOH)=___________。(保留三位有效数字)
(4)若改用含Na2O杂质的NaOH配制成标准溶液来滴定盐酸,测得的盐酸浓度将________。(选填“偏高”、“偏低”或“无影响”)
【答案】1000mL容量瓶 玻璃棒 滴入最后一滴盐酸时,溶液由红色变为无色,并且半分钟之内不恢复红色,说明达到滴定终点 26.10 0.104molL-1 偏低
【解析】
(1)配制1000mL溶液,需要1000mL的容量瓶,引流时还需要用到玻璃棒,所以配制溶液时,除烧杯、量筒和胶头滴管外,还需要的玻璃仪器有1000mL容量瓶和玻璃棒。
(2)该中和滴定用酚酞做指示剂,所以当滴入最后一滴盐酸时,溶液由红色变为无色,并且半分钟之内不恢复红色,说明达到滴定终点;读数时,视线与滴定管内凹液面最低点相平,读到0.01mL,起始读数为0.00mL,终点读数为26.10mL,所以终点读数为26.10 mL。
(3)三次消耗的盐酸的体积分别为 26.11mL,28.74mL,26.09mL,第二次数据误差过大,舍去;另外两次的平均值为(26.11+26.09)mL÷2=26.10mL,c(NaOH)=(0.1000mol/L×0.0261L)÷0.025L=0.104(mol/L)。
(4)若含Na2O杂质,根据反应Na2O+2HCl=2NaCl+H2O,该反应31g消耗1mol盐酸,而NaOH+HCl=NaCl+H2O,该反应40g消耗1mol杂质,导致消耗的标准液体积减小,测定结果偏低。

【题目】用活性炭还原法可以处理氮氧化物。如反应:![]()
![]() 。在
。在![]() 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下:
0 | 10 | 20 | 30 | 40 | 50 | |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
(1)T1℃时,该反应的平衡常数![]() ______
______
(2)30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ______ ![]() 答一种即可
答一种即可![]()