题目内容
20.碳是化合物种类最多的元素,其单质及化合物是人类生产生活的主要能源物质.请回答下列问题:(1)有机物M经过太阳光光照可转化成N,转化过程如下:则M、N相比,较稳定的是M.

(2)已知CH3OH(l)的燃烧热△H=-238.6kJ/mol,CH3OH(l)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-a kJ/mol,则a<(填“>”、“<”或“=”)238.6.
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1mol Cl2参与反应时释放出145kJ热量,写出该反应的热化学方程式:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1 .
(4)家用液化气中主要成分之一是丁烷,当10g丁烷完全燃烧并生成CO2和液态水时,放出热量500kJ.试写出丁烷燃烧的热化学方程式C4H10 (g)+6.5 O2 (g)═4 CO2 (g)+5 H2O (l)△H=-2900 kJ•mol-1.
分析 (1)M转化为N是吸热反应,所以N的能量高,不稳定;
(2)甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量少,故a<238.6;
(3)有1mol Cl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,注物质聚集状态和对应反应焓变写出热化学方程式;
(4)依据热化学方程式的书写方法写出,标注物质的聚集状态和对应系数下的反应焓变.
解答 解:(1)有机物M经过太阳光光照可转化成N,:△H=+88.6kJ•mol-1,过程是吸热反应,N暗处转化为M,是放热反应,能量越低越稳定,说明M稳定;
故答案为:M;
(2)燃烧热是1mol物质完全燃烧生成稳定氧化物放出的热量,甲醇燃烧生成CO2(g)和H2(g)属于不完全燃烧,放出的热量小于燃烧热,故答案为:<;
(3)有1mol Cl2参与反应时释放出145kJ热量,2mol氯气反应放热290kJ,反应的热化学方程式为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1 ;
故答案为:2Cl2(g)+2H2O(g)+C(s)═4HCl(g)+CO2(g)△H=-290kJ•mol-1 ;
(4)10g丁烷气体完全燃烧生成CO2和H2O(l)放出热量500 kJ,则58g丁烷反应生成CO2和H2O(l)放热$\frac{500}{10}$×58=2900KJ;
丁烷燃烧的热化学方程式为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-2900KJ/mol;
故答案为:2C4H10(g)+13O2(g)=8CO2(g)+10H2O(l)△H=-2900KJ/mol.
点评 本题考查了化学反应能量变化,燃烧热概念分析判断,氧化还原反应电子转移的计算应用,掌握基础是解题关键,题目难度中等.

 ABC考王全优卷系列答案
ABC考王全优卷系列答案| A. | 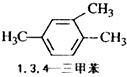 | B. | 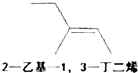 | C. | 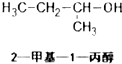 | D. |  |
| A. | 任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 | |
| B. | 同温同压下,H2 (g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同 | |
| C. | 已知:①2H2(g)+O2(g)═2H2O(g)△H=-a kJ•mol-1,②2H2(g)+O2 (g)═2H2O(1)△H=-b kJ•mol-1,则a>b | |
| D. | 已知:①C(s,石墨)+O2 (g)═CO2(g)△H=-393.5 kJ•mol-1,②C(s,金刚石)+O2(g)═CO2 (g)△H=-395.0 kJ•mol-1,则C(s,石墨)═C(s,金刚石)△H=+1.5 kJ•mol-1 |
①FeCl3溶液可用于铜质印刷线路板制作是因为FeCl3能从含Cu2+的溶液中置换出铜
②室温下,不能将浓硫酸盛放在铁桶中
③K+、Fe3+、N${O}_{3}^{-}$、SCN-在水溶液中能大量共存
④因氧化铁能与酸反应,可用于制作红色涂料
⑤将Fe(NO)2样品溶于稀H2SO4后,滴加KSCN溶液观察溶液是否变红,可检验Fe(NO3)2晶体是否已氧化变质.
| A. | 仅①②③ | B. | 仅①③④ | C. | 仅②④⑤ | D. | 全部 |
| A. | 反应物能量总和大于生成物能量总和 | |
| B. | CO(g)+H2(g)?C(s)+H2O(l)△H=-131.4kJ•mol-1 | |
| C. | 水煤气反应中生成1molH2(g)吸收131.4 kJ热量 | |
| D. | 水煤气反应中生成1L CO(g)吸收131.4 kJ热量 |
| A. | 试管可作为反应容器 | |
| B. | 量筒用于量取一定液体药品 | |
| C. | 胶头滴管用过应立即清洗滴瓶中的滴管也是如此 | |
| D. | 烧杯常用作配制溶液和较大试剂的反应容器 |
| A. | 2KClO3$\frac{\underline{\;\;△\;\;}}{\;}$2KCl+3O2↑ | |
| B. | NH3+HCl═NH4Cl | |
| C. | Ba(OH)2+MgSO4═BaSO4↓+Mg(OH)2↓ | |
| D. | MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O |
