题目内容
【题目】铝有多种化合物,在工业上用途广泛。氮化铝(AlN)中混有碳和氧化铝,为确定某氮化铝样品的纯度,进行如下实验:(已知:AlN + H2O + NaOH→ NaAlO2 + NH3↑)
(1)称取5.00g样品,加入25mL5mol/L的NaOH溶液,共热,样品中AlN和Al2O3完全反应,测得放出氨气1.68L(标准状况)。该样品中的A1N的质量分数为___________。
(2)过滤上述混合溶液,向滤液中滴加2mol/L的盐酸,当滴至202mL时生成的白色沉淀恰好完全消失,5.00g样品中Al2O3的物质的量是多少摩________?(写出计算过程)
碱式碳酸铝镁[MgxAly(OH)a(CO3)b·nH2O]可做为塑料填料。为确定某碱式碳酸铝镁的组成,进行如下实验:
(3)称取3.390g样品与足量稀盐酸充分反应,生成二氧化碳0.560L(标准状况)。3.390g样品中含CO32―________g。
(4)另取100.00g样品在空气中加热,固体质量随温度的变化如图所示(样品在270℃时已完全失去结晶水,600℃以上固体为金属氧化物的混合物)。
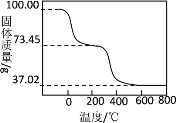
(i)100.00g样品中含结晶水_______mol。
(ii)100.00g样品中OH―的物质的量是多少_______?(写出计算过程)
(iii)通过计算推测该碱式碳酸铝镁的化学式_______。
【答案】0.615 0.009mol 1.5 1.475 0.4424mol Mg5Al (OH) 3(CO3)510H2O
【解析】
(1)由题意可知,AlN和Al2O3均能和NaOH反应,但是,只有AlN和NaOH反应放出NH3![]() ,据此计算;
,据此计算;
(2)滤液中加盐酸,先产生沉淀,继续滴加盐酸,沉淀逐渐溶解,发生的两个反应:HCl+NaOH=NaCl+H2O,NaAlO2+4HCl=AlCl3+2H2O+NaCl,NaOH为(1)中未反应的部分,此时溶液中溶质有两种:AlCl3和NaCl,根据原子守恒进行计算;
(3) 二氧化碳来源于碳酸根离子,根据C原子守恒计算n(CO32-),根据m=nM计算碳酸根离子质量;
(4)(i)样品在270℃时已完全失去结晶水,结晶水的质量=(100.00-73.45)g=26.55g,根据n=![]() 计算水的物质的量;
计算水的物质的量;
(ii)100.00g样品在270~600℃之间,失去结晶水后的样品进一步受热分解放出CO2和H2O,m(CO2)+m(H2O)=73.45-37.02=36.43g,根据质量分数不变计算100.00g该物质分解生成二氧化碳质量,从而计算氢氧根离子生成水的质量,从而计算氢氧根离子的物质的量;
(iii)根据电荷守恒、质量守恒计算x、y,从而确定化学式。
(1)AlN + H2O + NaOH→ NaAlO2 + NH3↑,该反应产生NH3的物质的量=![]() ,
,
AlN + H2O + NaOH→ NaAlO2 + NH3↑
0.075mol 0.075mol
所以AlN的质量=0.075mol![]() 41g·mol-1=3.075g,所以AlN的质量分数=
41g·mol-1=3.075g,所以AlN的质量分数=![]() ;故答案为:0.615;
;故答案为:0.615;
(2)向滤液中滴加2mol/L的盐酸,当滴至202mL时生成的白色沉淀恰好完全消失,溶液中溶质有两种:AlCl3和NaCl,设AlCl3的物质的量为x,NaCl的物质的量为y,根据Na原子守恒可知:y=5mol/L×25ml×10-3=0.125mol,由Cl守恒可知:3x+y=2mol/L×202×10-3L=0.404mol,解得x=0.093mol,所以此时溶液中有0.093molAlCl3,因为AlN物质的量=0.075mol,根据Al守恒可得n(Al2O3)=![]() 0.009mol,故答案为:0.009mol;
0.009mol,故答案为:0.009mol;
(3) n(CO2)=![]() =0.025mol,二氧化碳来源于碳酸根离子,根据C原子守恒得n(CO32-)=n(CO2)=0.025mol,则m(CO32-)=nM=0.025mol×60g/mol=1.5g,故答案为:1.5;
=0.025mol,二氧化碳来源于碳酸根离子,根据C原子守恒得n(CO32-)=n(CO2)=0.025mol,则m(CO32-)=nM=0.025mol×60g/mol=1.5g,故答案为:1.5;
(2)①样品在270℃时已完全失去结晶水,结晶水的质量=(100.00-73.45)g=26.55g,n(H2O)=![]() =
=![]() =1.475mol,故答案为:1.475;
=1.475mol,故答案为:1.475;
②100.00g样品在270~600℃之间,失去结晶水后的样品进一步受热分解放出CO2和H2O,m(CO2)+m(H2O)=73.45-37.02=36.43g,其中n(CO2)=0.56L/22.4mol/L=0.025mol;m(CO2)=![]() =32.45g,m(H2O)=36.43-32.45=3.98g,n(H2O)=
=32.45g,m(H2O)=36.43-32.45=3.98g,n(H2O)=![]() =0.2212mol,根据H原子守恒得n(OH-)=2n(H2O)=0.4424mol,故答案为;0.4424mol;
=0.2212mol,根据H原子守恒得n(OH-)=2n(H2O)=0.4424mol,故答案为;0.4424mol;
③根据电荷守恒得2x+3y=0.4424×1+2×![]() ……I,根据质量守恒得40x+0.5×102y=37.02……II,联合I、II得x=0.7374mol、y=0.1476mol,x:y:a:b:n=0.7374mol:0.1476mol:0.444mol:0.7374mol:
……I,根据质量守恒得40x+0.5×102y=37.02……II,联合I、II得x=0.7374mol、y=0.1476mol,x:y:a:b:n=0.7374mol:0.1476mol:0.444mol:0.7374mol:![]() :1.475mol=5:1:3:5:10,所以其化学式为Mg5Al (OH) 3(CO3)510H2O,故答案为:Mg5Al (OH)3(CO3)510H2O。
:1.475mol=5:1:3:5:10,所以其化学式为Mg5Al (OH) 3(CO3)510H2O,故答案为:Mg5Al (OH)3(CO3)510H2O。

 阅读快车系列答案
阅读快车系列答案