题目内容
7.铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到氢气2b g,且向反应后的溶液中加入KSCN溶液,不显红色,则原混合物中氧化铁的物质的量为$\frac{1}{2}$(a-b) mol.分析 固体加盐酸全部溶解,溶液加入KSCN溶液不显红色说明三价铁全被还原为Fe2+.根据生成氢气的物质的量计算与酸反应的铁的物质的量,其余的铁则和Fe2O3以等物质的量溶于盐酸生成FeCl2,即Fe+Fe2O3+6H+=3Fe2++3H2O,据此计算.
解答 解:根据电子转移守恒,与H+反应生成H2的铁的物质的量等氢气的物质的量,即n(Fe)=n(H2)=bmol;
其余的铁则和Fe2O3以等物质的量溶于盐酸生成FeCl2,即Fe+Fe2O3+6H+=3Fe2++3H2O,故氧化铁的物质的量为$\frac{1}{2}$(a-b)mol,
故答案为:$\frac{1}{2}$(a-b).
点评 本题考查混合物有关计算,难度中等,清楚反应过程是解题关键,注意利用总反应方程式解答,侧重对学生思维能力考查.

练习册系列答案
相关题目
19.NA为阿伏伽德罗常数.下列说法正确的是( )
| A. | 25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| B. | 常温常压下,8gO2含有4NA个电子 | |
| C. | 标准状况下,2024L乙醇含有0.1nA个CH3CH2OH分子 | |
| D. | KIO3+6HI=KI+3H2O+3I2,生产3molI2转移电子的总数为5NA |
15.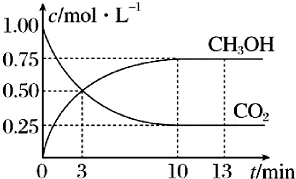 已知:CO2(g)+3H2(g)?CH5OH(g)+H2O(g)△H=-49.0kJ•mol-1一定条件下,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图所示,下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH5OH(g)+H2O(g)△H=-49.0kJ•mol-1一定条件下,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图所示,下列叙述中正确的是( )
 已知:CO2(g)+3H2(g)?CH5OH(g)+H2O(g)△H=-49.0kJ•mol-1一定条件下,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图所示,下列叙述中正确的是( )
已知:CO2(g)+3H2(g)?CH5OH(g)+H2O(g)△H=-49.0kJ•mol-1一定条件下,向体积为1L的恒容密闭容器中充入1mol CO2和3mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化曲线如图所示,下列叙述中正确的是( )| A. | 3min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| B. | 从反应开始到平衡,H2的平均反应速率v(H2)=0.225mol•L-1•min-1 | |
| C. | 13min时,向容器中充入2mol氦气,该反应的化学反应速率增大 | |
| D. | 13min时,向容器中充入2mol CO2,该反应化学平衡常数增大 |
12.硼镁泥主要成份是MgO(占35%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质.从硼镁泥中提取MgSO4•7H2O的流程如下:

已知:NaClO与Mn2+反应产生MnO2沉淀.
根据题意回答第(1)~(5)题:
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:升温、把硼镁泥粉碎、搅拌等.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2.
(4)已知MgSO4、CaSO4的溶解度如下表:
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤是蒸发浓缩,趁热过滤.“操作I”是将滤液继续蒸发浓缩,冷却结晶,过滤洗涤干燥,便得到了MgSO4•7H2O.
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为80%.

已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:升温、把硼镁泥粉碎、搅拌等.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2.
(4)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为80%.
19.下列物质中不能由单质直接化合生成的是( )
①CuS ②FeS ③SO3 ④H2O ⑤FeCl2 ⑥NH3.
①CuS ②FeS ③SO3 ④H2O ⑤FeCl2 ⑥NH3.
| A. | ①③⑤ | B. | ②④⑤ | C. | ①②④⑤ | D. | ①②③④⑤⑥ |
16.下列反应的离子方程式正确的是( )
| A. | 钠与水的反应:2Na+2H+=2Na++H2↑ | |
| B. | 铜与浓硝酸反应:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O | |
| C. | 铜与硝酸银溶液反应:Cu+Ag+=Ag+Cu2+ | |
| D. | 用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
17.下列图示与对应的叙述不相符的是( )


| A. | 图1表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的过饱和溶液 | |
| B. | 图2表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. | 图3表示0.1000mol•L-1 NaOH溶液滴定20.00mL 0.1000mol•L-1盐酸溶液得到的滴定曲线 | |
| D. | 图4表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件可能是增大压强 |