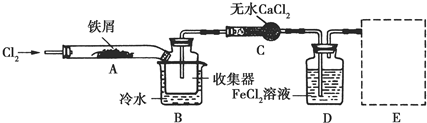
题目内容
12.硼镁泥主要成份是MgO(占35%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质.从硼镁泥中提取MgSO4•7H2O的流程如下:
已知:NaClO与Mn2+反应产生MnO2沉淀.
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
(1)在酸解过程中,欲加快酸解时的化学反应速率,请提出两种可行的措施:升温、把硼镁泥粉碎、搅拌等.
(2)加入的NaClO可与Mn2+反应:Mn2++ClO-+H2O=MnO2↓+2H++Cl-,还有一种离子也会被NaClO氧化,并发生水解,该反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+.
(3)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有SiO2.
(4)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
(5)实验中提供的硼镁泥共100g,得到的MgSO4•7H2O为172.2g,计算MgSO4•7H2O的产率为80%.
分析 硼镁泥主要成份是MgO(占35%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸,MgO、CaO、MnO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤除去滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,滤液中含钙离子、镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体.
(1)从影响反应速率的因素分析;
(2)溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应;
(3)二氧化硅不与稀硫酸反应,所以在滤渣中存在;
(4)根据表中温度对硫酸镁、硫酸钙的影响完成;根据分离晶体与溶液方法分析;
(5)根据硼镁泥中MgO的质量分数(占35%),结合Mg原子守恒计算出生成MgSO4•7H2O质量及产率.
解答 解:硼镁泥主要成份是MgO(占35%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,加入硫酸,MgO、CaO、MnO、Fe2O3、FeO、Al2O3都和硫酸反应,SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液pH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤除去滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,滤液中含钙离子、镁离子,除钙后,只剩镁离子,蒸发冷却结晶得到硫酸镁晶体.
(1)升高温度,增大接触面积,搅拌、增大反应物的浓度都可加快反应速率,故答案为:升温;把硼镁泥粉碎、搅拌等;
(2)溶液中含有Fe2+,具有还原性,可与NaClO发生氧化还原反应,并发生水解,反应的离子方程式为2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+,
故答案为:2Fe2++ClO-+5H2O=2Fe(OH)3↓+Cl-+4H+;
(3)SiO2不与硫酸反应,次氯酸钠具有强氧化性,加入的NaClO可与Mn2+反应生成MnO2,把亚铁离子氧化成铁离子,溶液PH升高,铁离子生成氢氧化铁沉淀,铝离子形成氢氧化铝沉淀,过滤得滤渣Fe(OH)3、Al(OH)3、MnO2、SiO2,故答案为:SiO2;
(4)有温度对硫酸镁、硫酸钙的溶解度影响,温度越高,硫酸钙溶解度越小,可以采用蒸发浓缩,趁热过滤方法除去硫酸钙;操作I”是将滤液继续蒸发浓缩,冷却结晶,再经过过滤洗涤干燥,便得到MgSO4•7H2O,
故答案为:趁热过滤;过滤洗涤干燥;
(5)100g硼镁泥中氧化镁的物质的量为$\frac{100g×35%}{40g/mol}$=0.875mol,根据镁原子守恒,生成MgSO4•7H2O的物质的量为0.875mol,质量为246g/mol×0.875mol=215.25g,MgSO4•7H2O的产率为$\frac{172.2g}{215.25g}$×100%=80.0%,
故答案为:80.0%.
点评 本题考查从硼镁泥中提取MgSO4•7H2O的方法,为高频考点,涉及反应速率、氧化还原反应及产率计算等,侧重考查学生分析、应用及计算能力的综合考查,注意元素化合物知识、化学实验及反应原理的综合应用,题目难度较大.

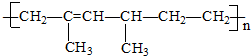
| A. | 2,4-二甲基-2-已烯 | B. | 2,4-二甲基-1,3-已二烯 | ||
| C. | 乙烯和2-甲基-1,3-戊二烯 | D. | 烯和2-甲基-1,3-丁二烯 |
| A. | 酸性氧化物 | B. | 有机物 | C. | 碱性氧化物 | D. | 混合物 |
| 相关信息 | |
| A | 所处的周期数、族序数分别与其原子序数相等 |
| B | 核外有3种不同原子轨道,每个轨道容纳的电子数相等 |
| C | 基态时,2p轨道处于半充满状态 |
| D | 与C元素处于同一周期,且D的第一电离能小于C的第一电离能 |
| E | 是目前生产、生活中应用最广泛的金属 |
(1)E位于元素周期表第四 周期第Ⅷ族,其简化电子排布式为[Ar]3d64s2.
(2)D原子最外层电子排布图是

(3)A和B按照 1:1组成的相对分子质量最小的化合物甲中
①每个甲分子中含有3个σ键.
②甲气体常用作燃料电池的负极材料,写出在NaOH溶液中甲用作负极的电极反应式C2H2-10e-+14OH-=2CO32-+8H2O.
(4)A和C组成的固体化合物AC5,它的所有原子的最外层都符合相应稀有气体原子的最外电子层结构,写出固体化合物AC5 的电子式
 .
.(5)已知在元素周期表中存在“对角线规则”,即周期表中左上方与右下方元素它们的单质及其化合物的性质相似,如Li和Mg,试写出向BeCl2溶液中加入过量的NaOH溶液反应的化学方程式:BeCl2+4NaOH═Na2BeO2+2NaCl+2H2O.
| A. | 1molCl2通入足量水中转移电子数为NA | |
| B. | 在0℃、101kPa时,22.4L H2中含有NA个H | |
| C. | 14gN2中含有7NA个电子 | |
| D. | NA个CO分子和0.5molCH4的质量比为7:4 |
| A. | 我国以三个强度等级(42.5、52.5、62.5)表示水泥的性能,等级越高性能越好 | |
| B. | 光导纤维的主要成分是石英玻璃 | |
| C. | 新型陶瓷分成两大类,即结构陶瓷(如纳米陶瓷)和功能陶瓷(如生物陶瓷) | |
| D. | 在玻璃中加入金属氧化物,可以使玻璃呈现颜色,例如加入氧化亚铜(Cu2O)呈蓝色 |
| A. | 在标准状况下,0.5molNO与0.5molO2混合后气体分子数为0.75NA | |
| B. | 1.0L、1.0mol/L的Na2SiO3水溶液中含有的氧原子数为3NA | |
| C. | 0.1mol AlCl3完全转化为氢氧化铝胶体,生成0.lNA个胶体粒子 | |
| D. | 常温常压下,14g的C2H4和C4H8混合气体中含有的原子数为3NA |