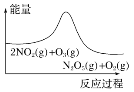
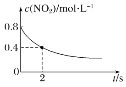
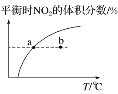
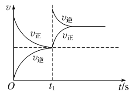
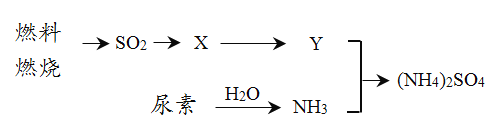
题目内容
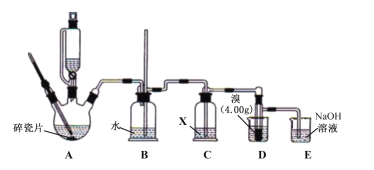
【题目】实验室可利用SO2与Cl2在活性炭的催化下制取一种重要的有机合成试剂磺酰氯(SO2Cl2)。所用的反应装置如图所示(部分夹持装置省略)。已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,遇潮湿空气会产生白雾。
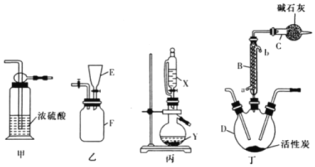
(1)化合物SO2Cl2中S元素的化合价为__。
(2)仪器D的名称是___。
(3)乙、丙装置制取原料气Cl2与SO2。
①乙装置F中充满Cl2,则E中所盛放的溶液为___(填溶液的名称)。
②丙装置中试剂X、Y的组合最好是__。
A.98%浓硫酸+Cu B.70%H2SO4+Na2SO3 C.浓HNO3+Na2SO3
(4)上述装置的正确连接顺序为__、__、丁、__、__(用甲、乙、丙表示,可重复使用)__。
(5)B装置中从a口通入冷水的作用是__;C装置的作用是__。
(6)SO2Cl2遇水能发生剧烈的水解反应,会产生白雾,则SO2Cl2发生水解反应的化学方程式为__。
(7)若反应中消耗氯气的体积为1.12L(已转化为标准状况,SO2足量),最后通过蒸馏得到纯净的磺酰氯5.13g,则磺酰氯的产率为__(保留三位有效数字)。
【答案】+6 三颈烧瓶(或三口烧瓶) 饱和食盐水或饱和氯化钠溶液 B 丙甲甲乙(或乙甲甲丙) 冷凝回流 防止空气中的水蒸气进入装置D中,同时吸收SO2与Cl2,防止污染空气 SO2Cl2+2H2O=H2SO4+2HCl 76.0%
【解析】
本实验目的是利用SO2与Cl2在活性炭的催化下制取磺酰氯(SO2Cl2),需要将氯气和二氧化硫通入装置丁中进行反应,而SO2Cl2遇水能发生剧烈的水解反应,遇潮湿空气会产生白雾,所以气体通入装置丁之前需要先进行干燥,同时装置C可以防止空气中的水蒸气进入反应装置,同时可以吸收尾气;SO2Cl2熔沸点较低,为减少其挥发损耗,加装球形冷管冷凝回流;乙装置F中充满氯气,实验时需要将集气瓶内的氯气排出,可在装置E中盛放饱和食盐水;装置丙制备二氧化硫,实验室常用浓硫酸和亚硫酸钠反应制备二氧化硫。
(1)SO2Cl2中氧元素-2价,氯元素-1价,故硫元素+6价;
(2)根据仪器D的结构特点可知其为三颈烧瓶;
(3)①E中溶液需要将集气瓶中的氯气排出,则对氯气的溶解度应很小,应选用饱和食盐水;
②丙为制取二氧化硫的装置,选用浓硫酸和亚硫酸钠,但硫酸浓度不能太大,否则不易电离出氢离子,不利于二氧化硫的生成,70%H2SO4和Na2SO3即可;铜与浓硫酸的反应需要加热,浓硝酸具有强氧化性会将亚硫酸根氧化成硫酸根,得不到二氧化硫,所以选B;
(4)由丙制备二氧化硫,经过甲干燥,由乙提供氯气,经过甲干燥,在丁中反应得到产品,则连接顺序为丙、甲、丁、甲、乙或乙、甲、丁、甲、丙;
(5)SO2Cl2沸点较低,冷凝管可使挥发的产物SO2Cl2冷凝回流;SO2Cl2遇水反应,应注意隔离水分,同时参与反应的气体均为有毒气体,不能直接排放,故装置c的作用是防止空气中的水蒸气进入装置D中,同时吸收二氧化硫和氯气,防止污染空气;
(6)SO2Cl2发生水解反应得到硫酸和盐酸,化学方程式为:SO2Cl2+2H2O=H2SO4+2HCl;
(7)反应中消耗氯气的体积为1.12L,则反应氯气的物质的量为0.05mol,根据氯元素守恒,理论上得到的磺酰氯(SO2Cl2)也为0.05mol,则磺酰氯的产率为![]() =76.0%。
=76.0%。

【题目】以![]() 、软锰矿(主要成分为
、软锰矿(主要成分为![]() ,少量
,少量![]() 及
及![]() 的化合物等)、氨水及净化剂等为原料可制备
的化合物等)、氨水及净化剂等为原料可制备![]() 液和
液和![]() ,主要实验步骤如下
,主要实验步骤如下

步骤I、如图所示装置,将![]() 通入
通入![]() 中的软锰矿浆液中
中的软锰矿浆液中![]() 。
。
步骤II、充分反应后,在不断搅拌下依次向仪器![]() 中加入适量纯净的
中加入适量纯净的![]() ,最后加入适量
,最后加入适量![]() 沉铅,
沉铅,
步骤III、过滤得![]() 溶液
溶液
(1)仪器R的名称是_______。
(2)装置![]() 用于制取
用于制取![]() ,反应的化学方程式为_________。
,反应的化学方程式为_________。
(3)装置![]() 中的反应应控制在90~100℃,适宜的加热方式是______________。
中的反应应控制在90~100℃,适宜的加热方式是______________。
(4)装置![]() 的作用是______________________。
的作用是______________________。
(5)“步骤Ⅱ”中加入纯净![]() 的目的是_______________,用
的目的是_______________,用![]() 调节溶液
调节溶液![]() 时,需调节溶液
时,需调节溶液![]() 的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的
的范围为________(该实验条件下,部分金属离子开始沉淀和沉淀完全的![]() 如下表)
如下表)
金属离子 |
|
|
|
|
开始沉淀的 | 7.04 | 1.87 | 3.32 | 7.56 |
沉淀完全的 | 9.18 | 3.27 | 4.9 | 10.2 |
(6)已知①用空气氧化![]() 浊液可制备
浊液可制备![]() ,主要副产物为
,主要副产物为![]() ;反应温度和溶液
;反应温度和溶液![]() 对产品中
对产品中![]() 的质量分数的影响分别如图所示
的质量分数的影响分别如图所示

②反应温度超过![]() 时,
时,![]() 的产率开始降低,
的产率开始降低,![]() 是白色沉淀,
是白色沉淀,![]() 呈黑色;
呈黑色;![]() 、
、![]() 中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到
中锰的质量分数理论值依次为72.05%、62.5%请补充完整由步骤III得到![]() 溶液,并用氨水等制备较纯净的
溶液,并用氨水等制备较纯净的![]() 的实验方案:______________________,真空干燥6小时得产品
的实验方案:______________________,真空干燥6小时得产品![]() 。
。