题目内容
【题目】2019年10 月9 日诺贝尔化学奖授予三位化学家,以表彰其对研究开发锂离子电池作出的卓越贡献。PC15、LiFePO4聚乙二醇、LiPF6、LiAsF6等可作制锂离子电池的材料。回答下列问题:
(l)Fe 的价层电子排布式为______________。Li、Fe、Cl、P 四种元素的第一电离能由大到小的顺序为___________________。
(2) PC13中心原子P 杂化类型是___________。将氨水和FeCl3 溶液混合后过滤出沉淀,再将沉淀溶入KOH 饱和溶液中,得到6 – 羟基配合物溶液,该配合物的化学式为_____。
(3)下列物质沸点最高的是_____________。
.A.正戊烷[ CH3 ( CH2)3CH3 ] B. l-丙醇 ( CH3 CH2 CH2OH)
C.乙二醇( HOCH2 CH2OH) . D. 丙醛( CH3CH2 CHO)
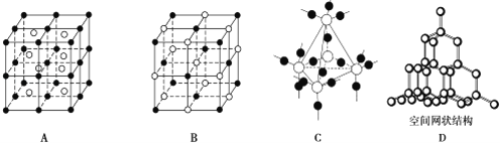
(4)熔融的PC15冷却后变为白色的离子晶体,晶体的晶胞如图所示,测得其中含有一种正四面体形阳离子和一种正八面体形阴离子,写出阴、阳离子的化学式 __________;正四面体形阳离子中键角大于PC13 的键角原因为______________。

(5)电池工作时,Li+ 沿聚乙二醇分子中的碳氧链迁移的过程如图甲所示(图中阴离子未画出)。电解质LiPF6或LiAsF6的阴离子结构如图所示(X=P、As)。

相同条件,Li+ 在LiAsF6 中比在LiPF6 中迁移较快,原因是 ________________。
【答案】3d64s2 P>Cl> Fe > Li sp3 K3[ Fe( OH )6] C PCl4+ 、PC16- PC13分子中P原子有—对孤电子对,PCl4+ 中P 没有孤电子对,孤电子对对成键电子的排斥力大于成键电子对间的排斥力 AsF6-的半径比P F6-大 ,AsF6-与Li+ 的作用力比P F6-的弱(或Li+ 与 AsF6-形成的离子键更弱或晶格能更小)
【解析】
(1)Fe为26号元素,根据核外电子排布式进行分析;
金属性越强,第一电离能一般较小,同周期,同周期自左而右元素的第一电离能呈增大趋势,但P最外层3p能级容纳3的电子,为半满稳定状态,能量较低;
(2)根据价层电子对互斥理论来分析解答,价层电子对个数=σ键个数+孤电子对个数;
(3)根据反应物分析6 – 羟基配合物的化学式;
由于醛的极化度很大,所以沸点比烷烃高,醇分子间形成氢建 故沸点比醛高,醇羟基数目越多沸点越高,故所以沸点顺序:醇>醛>烷烃;
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PC16-;PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,正四面体形阳离子中键角小于PCl3的键角;
(5)AsF6-的半径比PF6-的大,AsF6-与Li+的作用力比PF6-弱,则Li+在LiAsF6中迁移较快。
(1)Fe为26号元素,核外电子排布式为1s22s22p63s23p63d64s2,故价层电子排布式为3d64 s2;
金属性越强,第一电离能一般较小,同周期,同周期自左而右元素的第一电离能呈增大趋势,但P最外层3p能级容纳3的电子,为半满稳定状态,能量较低,第一电离能也高于同周期相邻元素,故第一电离能P大于Cl,Li、Fe、Cl、P 四种元素的第一电离能由大到小的顺序为P>Cl> Fe > Li;
(2)三氯化磷分子中价层电子对个数=σ键个数+孤电子对个数=3+![]() (5-3×1)=4,所以磷原子采用sp3杂化;
(5-3×1)=4,所以磷原子采用sp3杂化;
将氨水和FeCl3 溶液混合后过滤出沉淀Fe(OH)3,再将沉淀溶入KOH 饱和溶液中,得到6 – 羟基配合物溶液,该配合物的化学式为K3[ Fe( OH )6];
(3)根据反应物分析6 – 羟基配合物的化学式;
由于醛的极化度很大,所以沸点比烷烃高,醇分子间形成氢建 故沸点比醛高,醇羟基数目越多沸点越高,故所以沸点顺序:醇>醛>烷烃;
答案选C;
(4)PCl5是一种白色晶体,在恒容密闭容器中加热可在148℃液化,形成一种能导电的熔体,说明生成自由移动的阴阳离子,一种正四面体形阳离子是PCl4+和一种正六面体形阴离子是PCl6-;PCl3中价层电子对个数=σ键个数+孤电子对个数=3+![]() =4,所以原子杂化方式是sp3,PCl5中价层电子对个数=σ键个数+孤电子对个数=5+
=4,所以原子杂化方式是sp3,PCl5中价层电子对个数=σ键个数+孤电子对个数=5+![]() =4,所以原子杂化方式是sp3,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以PCl5中正四面体形阳离子中键角小于PCl3的键角;
=4,所以原子杂化方式是sp3,PCl3分子中P原子有一对孤电子对,PCl4+中P没有孤电子对,孤电子对对成键电子的排斥力大于成键电子对间的排斥力,所以PCl5中正四面体形阳离子中键角小于PCl3的键角;
(5)AsF6-的半径比PF6-的大,AsF6-与Li+的作用力比PF6-弱,则Li+在LiAsF6中迁移较快。

【题目】氨气可作为脱硝剂,在恒温恒容密闭容器中充入一定量的NO和NH3,在一定条件下发生反应:6NO(g)+4NH3(g)![]() 5N2(g)+6H2O(g)。
5N2(g)+6H2O(g)。
一定条件下,在2L密闭容器内,反应2NO2![]() N2O4,n(NO2)随时间变化如表:
N2O4,n(NO2)随时间变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
用NO2表示0~2s内该反应的平均反应速率___。在第5s时,NO2的转化率为___。根据表中可以看出,随着反应进行,反应速率逐渐减小,其原因是__。
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验:
(1)取冰醋酸配制250mL 0.4 mol·L-1的醋酸溶液,用0.4mol·L-1的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
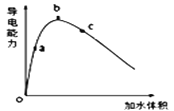
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。则稀释过程中溶液的pH由大到小的顺序____(填字母)。
②为标定该醋酸溶液的准确浓度,用0.2000mol·L-1的NaOH溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
该醋酸溶液的准确浓度为_____________(保留小数点后四位),上述标定过程中,造成测定结果偏高的原因可能是_____________(多选、错选不得分)。
a.未用标准液润洗碱式滴定管
b.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
c.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
d.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
(2)该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度( mol·L-1) | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
①根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是___________。
②简述用pH试纸测 0.1mol·L-1 醋酸溶液pH的方法___________。