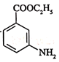
��Ŀ����
����Ŀ�����ֶ�����Ԫ��A��B��C��Dԭ���������ε�����ԭ�Ӱ뾶��С�� B��C��D��A������Ԫ��֮�������γɵ�����18���ӽṹ�ķ��ӣ����ǵ����ģ�ͼ������������±���
�� | �� | �� |
|
|
|
��ɫҺ�壬����ǿ�����ԣ������������� | ������ܶ�ԼΪ1.34g/L����Ȼ���еijɷ�֮һ | Һ̬������ǿ��ԭ�ԣ���������ƽ���ȼ�� |
(1)д����ѧʽ����___________����_____________��
(2)Ԫ��B������________��������ͬ�ĵ��ӣ����γɵĵ��ʾ��������__________��
a�����Ӿ��� b�����Ӿ��� c��ԭ�Ӿ��� d����������
(3)��֪1g Һ̬��������Һ̬��Ӧ���ɵ�����ˮ���������ų�20.05kJ��������д����Ӧ���Ȼ�ѧ����ʽ________________��
(4)��ƽ�������ƺ͵������������Һ�ﷴӦ�Ļ�ѧ����ʽ��
____Na2SO3+___KIO3+___H2SO4____Na2SO4+____K2SO4+____I2+ ____H2O��
(5)�÷�Ӧ���̽ϸ��ӣ�һ����Ϊ�����¼�����
��IO3��+SO32��IO2��+SO42������Ӧ����
��IO2��+2SO32��I��+2SO42������Ӧ�죩
��5I��+6H++IO3��3I2+3H2O����Ӧ�죩
��I2+SO32��+H2O2I��+SO42��+2H+����Ӧ�죩
�������������Ʋ⣬�˷�Ӧ������________��������ţ���Ӧ������
(6)��Ԥ�ȼ��������Һ���ɷ�Ӧ���̿�������_______����������ʱ���Ż�����Һ���������������ԭ����_____________________��
���𰸡�H2O2 N2H4 3 bc N2H4��l��+2H2O2��l��=N2��g��+4H2O��g�� ��H=-641.6kJ/mol 5��2��1��5��1��1��1 �� SO32- SO32-�Ļ�ԭ�Դ���I�����ɱ�I2����
��������
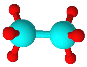
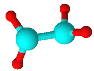
���ֶ�����Ԫ��A��B��C��Dԭ���������ε�����ԭ�Ӱ뾶��С��B��C��D��A������Ԫ��֮�������γɵ�����18���ӽṹ�ķ��ӣ����ǵ����ģ�ͼ����������������ΪҺ̬������ǿ�����ԣ������������������ΪH2O2����Ϊ��Ȼ���ijɷ�֮һ���ڱ�����ܶ�ԼΪ1.34g��L-1����Ħ������Ϊ��1.34g��L-1��22.4L/m ol=30g/mol��������ģ�Ϳ�֪��Ϊ���飻��ΪҺ̬������ǿ��ԭ�ԣ���������ƽ���ȼ�ϣ����ΪN2H4������ԭ��������֪��֪��AΪH��BΪC��CΪN��DΪO���ݴ˽��
��1����������������ΪH2O2����ΪN2H4���ʴ�Ϊ��H2O2��N2H4��
��2��Ԫ��BΪC��������6�����ӣ��ֱ�λ��1s��2s��2p����ϣ�����3��������ͬ�ĵ��ӣ�CԪ���γɵĵ��ʾ������Ϊ���Ӿ��塢ԭ�Ӿ��壬��C60�����ʯ���������γ����Ӿ���ͽ������壬�ʴ�Ϊ��3��bc��
��3��1gҺ̬����N2H4��������Һ̬�ף�H2O2����Ӧ����N2��H2O���壬���ų�20.05kJ����������1mol�·�Ӧ�ų�������Ϊ��32��20.05=641.6��kJ���������º������ⷴӦ���Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��g�� ��H=-641.6kJ/mol���ʴ�Ϊ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��g�� ��H=-641.6kJ/mol��
��4����Ӧ��SԪ�ػ��ϼ���Na2SO3��+4������Ϊ+6�ۣ��ܹ�����2�ۣ�IԪ�ػ��ϼ���KIO3��+5����ΪI2��0�ۣ��ܹ�����10�ۣ����ϼ���С������Ϊ10����Na2SO3ϵ��Ϊ5����I2ϵ��Ϊ1���ٽ��ԭ���غ���ƽ��ʽΪ5Na2SO3+2KIO3+H2SO4��5Na2SO4+K2SO4+I2+H2O���ʴ�Ϊ��5��2��1��5��1��1��1��
��5��������Ӧ����������Ӧ���̵����ʣ��ʷ�Ӧ�����ɢٲ���Ӧ�������ʴ�Ϊ���٣�
��6���ɷ�Ӧ�ܿ�֪��SO32-�Ļ�ԭ�Դ���I�����ɱ�I2����������������SO32-���Ż�����I2���Ż�����Һ����������������ʴ�Ϊ��SO32-��SO32-�Ļ�ԭ�Դ���I�����ɱ�I2������

����Ŀ������ͬ�¶Ⱥ�ѹǿ�£��Է�ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)���мס��ҡ�����������ʵ�飬ʵ����ʼʱ���������ڸ���ֵ����ʵ������±�
CO(g)��H2O(g)���мס��ҡ�����������ʵ�飬ʵ����ʼʱ���������ڸ���ֵ����ʵ������±�
| CO2 | H2 | CO | H2O |
�� | amol | amol | 0mol | 0mol |
�� | 2amol | amol | 0mol | 0mol |
�� | 0mol | 0mol | amol | amol |
�� | amol | 0mol | amol | amol |
������������ﵽƽ���n(CO)�Ĵ�С˳����
A. �ң�����������B. �ң������ף���
C. �����ң�������D. ���������ң���
����Ŀ���±��ж�Ӧ��ϵ��ȷ����( )
A | CH3CH3+Cl2 CH2=CH2+HCl��CH3CH2Cl | ��Ϊȡ����Ӧ |
B | ����֬�õ����ͣ���±�����ƴ� | ��������ˮ�ⷴӦ |
C | Cl2+2Br��2Cl+Br2��Zn+Cu2+��Zn2++Cu | ��Ϊ���ʱ���ԭ���û���Ӧ |
D | 2Na2O2+2H2O��4NaOH+O2���� 2F2+2H2O��4HF+ O2 | ��Ϊˮ����ԭ����������ԭ��Ӧ |
A.AB.BC.CD.D