��Ŀ����
����Ŀ���������ζ����ɲⶨBa2+�ĺ�����ʵ����������С�
��֪��2CrO42��(��ɫ)+ 2H+ �� Cr2O72��(�Ⱥ�ɫ)+ H2O Ba2+ + CrO42�� �� BaCrO4��
�������ȡx mLһ��Ũ�ȵ�Na2CrO4��Һ����ƿ�У��������ָʾ������b molL��1�����Һ�ζ����յ㣬��õμ��������ΪV0 mL��
�������ȡy mL BaCl2��Һ����ƿ�У�����x mL�벽�����ͬŨ�ȵ�Na2CrO4��Һ����Ba2+��ȫ�������ټ������ָʾ������b molL��1�����Һ�ζ����յ㣬��õμ���������ΪV1mL��BaCl2��Һ��Ũ��Ϊ_________________mol/L����x��y�ı���ʽ����������� �еμ�����ʱ����������Һ������Ba2+Ũ�Ȳ���ֵ��___________���ƫ��ƫС������
���𰸡�![]() ƫ��
ƫ��
��������
�ɻ�ѧ����ʽ2CrO42��+ 2H+�� Cr2O72��+ H2O֪������I�м����CrO42���������ʵ���Ϊbmol��L-1��![]() L=
L=![]() mol��������У�����BaCl2��ַ�Ӧ��ʣ���CrO42�������ʵ���Ϊ
mol��������У�����BaCl2��ַ�Ӧ��ʣ���CrO42�������ʵ���Ϊ![]() mol���ɷ���ʽBa2+ + CrO42�� �� BaCrO4���ã�n(Ba2+)=n(CrO42��)������BaCl2��Ũ�ȣ�c��BaCl2��=
mol���ɷ���ʽBa2+ + CrO42�� �� BaCrO4���ã�n(Ba2+)=n(CrO42��)������BaCl2��Ũ�ȣ�c��BaCl2��=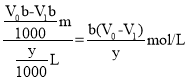 ����������еμ�����ʱ����������Һ�������������ĵ�������٣���V1��С����Ba2+Ũ�Ȳ���ֵ��ƫ�ʴ�Ϊ��
����������еμ�����ʱ����������Һ�������������ĵ�������٣���V1��С����Ba2+Ũ�Ȳ���ֵ��ƫ�ʴ�Ϊ��![]() ��ƫ��
��ƫ��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
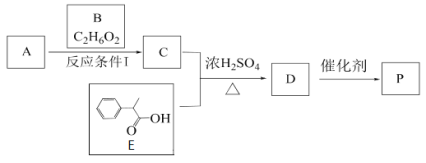
Сѧ��10����Ӧ����ϵ�д�����Ŀ��������ͼʾװ���о����ʵ����ʣ��ܹ���ÿɿ����۵���
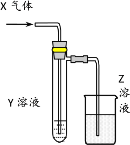
X | Y | Z | ���� | |
A | HCHO | ����Cu(OH)2 | NaOH(aq) | ��֤��ȩ�Ļ�ԭ�� |
B | CH3Cl | AgNO3(aq) | NaOH(aq) | ��֤һ�ȼ��麬��Ԫ�� |
C | SO2 | KMnO4(aq) | NaOH(aq) | ��֤���������Ư���� |
D | Cl2 | ����KI(aq) | NaOH(aq) | ��֤������ǿ������ |
A.AB.BC.CD.D
����Ŀ�����ֶ�����Ԫ��A��B��C��Dԭ���������ε�����ԭ�Ӱ뾶��С�� B��C��D��A������Ԫ��֮�������γɵ�����18���ӽṹ�ķ��ӣ����ǵ����ģ�ͼ������������±���
�� | �� | �� |
|
|
|
��ɫҺ�壬����ǿ�����ԣ������������� | ������ܶ�ԼΪ1.34g/L����Ȼ���еijɷ�֮һ | Һ̬������ǿ��ԭ�ԣ���������ƽ���ȼ�� |
(1)д����ѧʽ����___________����_____________��
(2)Ԫ��B������________��������ͬ�ĵ��ӣ����γɵĵ��ʾ��������__________��
a�����Ӿ��� b�����Ӿ��� c��ԭ�Ӿ��� d����������
(3)��֪1g Һ̬��������Һ̬��Ӧ���ɵ�����ˮ���������ų�20.05kJ��������д����Ӧ���Ȼ�ѧ����ʽ________________��
(4)��ƽ�������ƺ͵������������Һ�ﷴӦ�Ļ�ѧ����ʽ��
____Na2SO3+___KIO3+___H2SO4____Na2SO4+____K2SO4+____I2+ ____H2O��
(5)�÷�Ӧ���̽ϸ��ӣ�һ����Ϊ�����¼�����
��IO3��+SO32��IO2��+SO42������Ӧ����
��IO2��+2SO32��I��+2SO42������Ӧ�죩
��5I��+6H++IO3��3I2+3H2O����Ӧ�죩
��I2+SO32��+H2O2I��+SO42��+2H+����Ӧ�죩
�������������Ʋ⣬�˷�Ӧ������________��������ţ���Ӧ������
(6)��Ԥ�ȼ��������Һ���ɷ�Ӧ���̿�������_______����������ʱ���Ż�����Һ���������������ԭ����_____________________��
����Ŀ����úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ��ú������
(1)��ˮ����ͨ�����ȵ�̿���ɲ���ˮú������ӦΪC(s)��H2O(g)![]() CO(g)��H2(g) ��H����131.3 kJ��mol��1�� �÷�Ӧ�ڳ�����________����ܡ����ܡ����Է����С�
CO(g)��H2(g) ��H����131.3 kJ��mol��1�� �÷�Ӧ�ڳ�����________����ܡ����ܡ����Է����С�
(2)����ͬ����CO(g)��H2O(g)�ֱ�ͨ�����Ϊ2 L�ĺ����ܱ������У����з�ӦCO(g)��H2O(g) ![]() CO2(g)��H2(g)���õ������������ݣ�
CO2(g)��H2(g)���õ������������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
�÷�Ӧ������ӦΪ________��������š����ȷ�Ӧ��ʵ��2������ƽ�ⳣ��K��________��
(3)Ŀǰ��ҵ����һ�ַ�������CO2�������״���һ�������·�����Ӧ��CO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)����ͼ��ʾ�÷�Ӧ���й�������������λΪkJ��mol��1���ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2���ﵽƽ������д�ʩ����ʹc(CH3OH)�������________��
CH3OH(g)��H2O(g)����ͼ��ʾ�÷�Ӧ���й�������������λΪkJ��mol��1���ı仯�������Ϊ1 L�ĺ����ܱ������У�����1 mol CO2��3 mol H2���ﵽƽ������д�ʩ����ʹc(CH3OH)�������________��

a�������¶�
b������He(g)��ʹ��ϵѹǿ����
c����H2O(g)����ϵ�з������
d���ٳ���1 mol CO2��3 mol H2