题目内容
【题目】扎来普隆是一种短期治疗失眠症的药物,其合成路线如下:
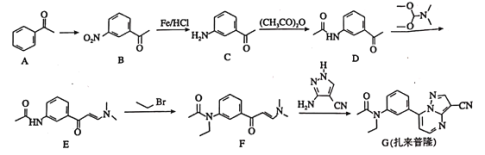
回答下列问题:
(1)A中的官能团名称是________________。
(2)![]() 所需的试剂和条件分别为________________。
所需的试剂和条件分别为________________。
(3)![]() 、
、![]() 的反应类型依次为________、________。
的反应类型依次为________、________。
(4)扎来普隆的分子式为________________。
(5)![]() 的化学方程式为________________________。
的化学方程式为________________________。
(6)属于芳香化合物,且含有硝基,并能发生银镜反应的B的同分异构体有________种(不考虑立体异构),其中核磁共振氢谱有4组峰的结构简式有________________。
(7)已知:![]() 有碱性且易被氧化。设计由
有碱性且易被氧化。设计由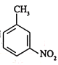 和乙醇制备
和乙醇制备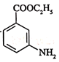 的合成路线(无机试剂任选)。________
的合成路线(无机试剂任选)。________
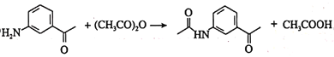
【答案】羰基(或酮基) 浓![]() ,浓
,浓![]() 还原反应 取代反应
还原反应 取代反应 ![]()
 17
17  、
、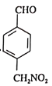
【解析】
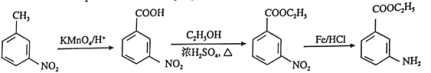
(7)因![]() 有碱性且易被氧化,则由
有碱性且易被氧化,则由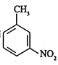 和乙醇制备
和乙醇制备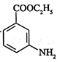 时,应先将-CH3氧化为-COOH,再与乙醇发生酯化反应,最后再将-NO2还原为-NH2,即可得到目标产物。
时,应先将-CH3氧化为-COOH,再与乙醇发生酯化反应,最后再将-NO2还原为-NH2,即可得到目标产物。
(1)A的结构简式为![]() ,含有的官能团名称是羰基;
,含有的官能团名称是羰基;
(2)A的结构简式为![]() ,B的结构简式为
,B的结构简式为![]() ,则
,则![]() 发生取代反应,所需的试剂和条件分别为浓
发生取代反应,所需的试剂和条件分别为浓![]() ,浓
,浓![]() ;
;
(3)由B的结构简式为![]() 、C的结构简式为
、C的结构简式为![]() 、E的结构简式为
、E的结构简式为![]() 、F的结构简式为
、F的结构简式为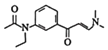 可知,
可知,![]() 是-NO2转化为-NH2,发生了还原反应,而
是-NO2转化为-NH2,发生了还原反应,而![]() 的反应类型为取代反应;
的反应类型为取代反应;
(4)扎来普隆的结构简式为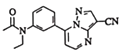 ,其分子式为
,其分子式为![]() ;
;
(5)C的结构简式为![]() 、D的结构简式为
、D的结构简式为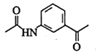 ,则
,则![]() 发生取代反应的化学方程式为
发生取代反应的化学方程式为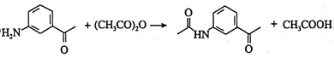 ;
;
(6)B的结构简式为![]() ,其属于芳香化合物,且含有硝基,并能发生银镜反应的同分异构体满足:①含有苯环和硝基;②含有-CH2CHO或一个甲基和一个-CHO;若为-NO2和-CH2CHO,则有4种结构,其中有一种为苯环上连接-CH(NO2)CHO;若为-NO2、-CH3和-CHO,则有4+4+2=10种,另外还有-CH2NO2和-CHO共有3种,共有4+10+3=17种,其中核磁共振氢谱有4组峰的结构简式有
,其属于芳香化合物,且含有硝基,并能发生银镜反应的同分异构体满足:①含有苯环和硝基;②含有-CH2CHO或一个甲基和一个-CHO;若为-NO2和-CH2CHO,则有4种结构,其中有一种为苯环上连接-CH(NO2)CHO;若为-NO2、-CH3和-CHO,则有4+4+2=10种,另外还有-CH2NO2和-CHO共有3种,共有4+10+3=17种,其中核磁共振氢谱有4组峰的结构简式有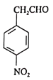 、
、 ;
;
(7)因![]() 有碱性且易被氧化,则由
有碱性且易被氧化,则由 和乙醇制备
和乙醇制备 时,应先将-CH3氧化为-COOH,再与乙醇发生酯化反应,最后再将-NO2还原为-NH2,具体合成路线为
时,应先将-CH3氧化为-COOH,再与乙醇发生酯化反应,最后再将-NO2还原为-NH2,具体合成路线为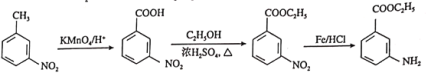 。
。

 暑假作业暑假快乐练西安出版社系列答案
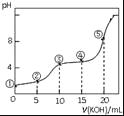
暑假作业暑假快乐练西安出版社系列答案【题目】四种短周期元素A、B、C、D原子序数依次递增,原子半径大小: B>C>D>A,四种元素之间两两形成的三种18电子结构的分子,它们的球棍模型及部分性质如下表:
甲 | 乙 | 丙 |
|
|
|
无色液体,具有强氧化性,可用作消毒剂 | 标况下密度约为1.34g/L,天然气中的成分之一 | 液态,具有强还原性,用作火箭推进的燃料 |
(1)写出化学式:甲___________、丙_____________。
(2)元素B核外有________种能量不同的电子,其形成的单质晶体可能是__________。
a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体
(3)已知1g 液态丙与足量液态甲反应生成氮气和水蒸气,并放出20.05kJ的热量,写出反应的热化学方程式________________。
(4)配平亚硫酸钠和碘酸钾在酸性溶液里反应的化学方程式:
____Na2SO3+___KIO3+___H2SO4____Na2SO4+____K2SO4+____I2+ ____H2O。
(5)该反应过程较复杂,一般认为分以下几步:
①IO3-+SO32-IO2-+SO42-(反应慢)
②IO2-+2SO32-I-+2SO42-(反应快)
③5I-+6H++IO3-3I2+3H2O(反应快)
④I2+SO32-+H2O2I-+SO42-+2H+(反应快)
根据上述条件推测,此反应速率由________步(填序号)反应决定。
(6)若预先加入淀粉溶液,由反应过程看,必在_______离子消耗完时,才会有溶液变蓝的现象产生。原因是_____________________。
【题目】以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业叫煤化工。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。 该反应在常温下________(填“能”或“不能”)自发进行。
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1。 该反应在常温下________(填“能”或“不能”)自发进行。
(2)将不同量的CO(g)和H2O(g)分别通入体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g) ![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 6 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
该反应的正反应为________(填“吸”或“放”)热反应,实验2条件下平衡常数K=________。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2,达到平衡后下列措施中能使c(CH3OH)增大的是________。

a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2