题目内容
11.短周期主族元素A、B原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素.试回答下列问题:①A的元素符号为O;D的原子结构示意图为
 .
.②A、B、C三种元素形成的简单离子的半径由大到小的顺序是S2->O2->Na+.
③A、B两元素形成的化合物与H2O反应能释放出氧气,其反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.
分析 A原子的最外层电子数是次外层电子数的3倍,则A原子有2个电子层,最外层电子数6,故A为O元素;A、C同主族,则C为S元素,B、C、D同周期,且B是短周期元素中原子半径最大的主族元素,则B为Na元素,D为Cl元素.根据原子结构以及对应的单质化合物的性质结合元素周期律的递变规律可解答该题.
解答 解:A原子的最外层电子数是次外层电子数的3倍,则A原子有2个电子层,最外层电子数6,故A为O元素;A、C同主族,则C为S元素,B、C、D同周期,且B是短周期元素中原子半径最大的主族元素,则B为Na元素,D为Cl元素.则
①A为O元素;D为氯元素原子核外有3个电子层,最外层电子数为7,原子结构示意图为: ,故答案为:O;
,故答案为:O; ;
;
②A、B、C三种元素形成的简单离子分别为O2-、Na+、S2-,其中S2-比O2-多一个电子层,则离子半径:S2->O2-,由于O2-和Na+核外电子排布相同,根据核电核数越大,半径越小可知半径O2->Na+,所以离子半径:S2->O2->Na+,故答案为:S2->O2->Na+;
③A为O元素、B为Na元素,A、B两元素形成的含有非极性键的化合物的化学式为Na2O2,过氧化钠与水反应生成氢氧化钠和氧气,故化学反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑.
点评 本题主要考查元素的推断以及元素化合物知识,解答本题时注意把握原子的结构特点,结合元素周期律知识进行推断,难度中等.

练习册系列答案
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
1.关于化学键的各种叙述中,下列说法中正确的是( )
| A. | 在离子晶体里,只存在离子键 | |
| B. | 共价化合物里,一定不存在离子键 | |
| C. | 非金属元素之间只能形成共价键 | |
| D. | 由不同种元素组成的多原子分子里,一定只有极性键 |
2.下表是元素周期表的一部分,针对表中的①~⑩中元素,用化学用语填空回答以下问题:
(1)在这些元素中,最活泼的非金属元素是F化学性质最不活泼元素原子的原子结构示意图为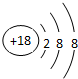 ;
;
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3;
(3)最强碱的电子式为: ①的气态氢化物的电子式:
①的气态氢化物的电子式: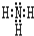 .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,呈两性的氢氧化物是Al(OH)3;
(3)最强碱的电子式为:
 ①的气态氢化物的电子式:
①的气态氢化物的电子式: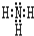 .
.
19.下列实验不合理的是( )
| A. | 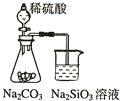 证明非金属性强弱 S>C>Si | B. | 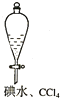 四氯化碳萃取碘水中的碘 | ||
| C. | 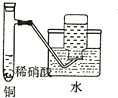 制备并收集少量NO气体 | D. | 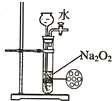 制备少量氧气 |
6.下列关于范德华力影响物质性质的叙述中,正确的是( )
| A. | 范德华力是决定由分子构成物质熔、沸点高低的惟一因素 | |
| B. | 范德华力与物质的性质没有必然的联系 | |
| C. | 范德华力能够影响物质的化学性质和物理性质 | |
| D. | 范德华力仅是影响物质部分物理性质的一种因素 |
16.x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
| A. | x的原子半径大于y的原子半径 | B. | x的电负性大于y的电负性 | ||
| C. | x的能层数等于y的能层数 | D. | x的第一电离能小于y的第一电离能 |
1.如图所示是一个有机物的核磁共振氢谱图,请你观察图谱,分析其可能是下列物质中的( )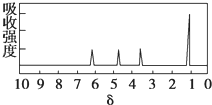

| A. | CH3CH2CH2CH3 | B. | (CH3)2CHCH3 | C. |  | D. | CH3CH2COOH |