题目内容
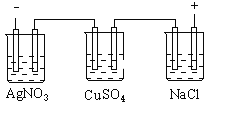
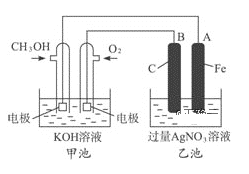
【题目】据报道,摩托罗拉公司开发了一种以甲醇为原料,以KOH溶液为电解质的用于手机的可充电的高效燃料电池,充一次电可连续使用一个月.右图是一个电化学过程的示意图.已知甲池的总反应式为: 2CH3OH+3O2+4KOH![]()
![]() 2K2CO3+6H2O
2K2CO3+6H2O
请填空:
(1)充电时:①燃料电池的正极与电源______极相连.
②阳极的电极反应式为__________________________________.
(2)放电时:负极的电极反应式为______________________________.
(3)在此过程中若完全反应,乙池中A极的质量增加324g,则甲池中理论上消耗O2______L(标准状况下).
(4)工业上用3克氢气与足量二氧化碳反应生成气态甲醇(CH3OH)和水蒸气,放出24.5千焦的热量,请写出该反应的热化学反应方程式:_________________________.
(5)用该电池为电源电解氯化镁制取金属镁,消耗甲醇1.6g,可制得金属镁______g.
【答案】正 4OH--4e-=2H2O+O2↑ CH3OH+8OH--6e-=CO32-+6H2O 16.8 3H2(g)+CO2(g)=H2O(g)+CH3OH(g)△H=-49.0kJ·mol-1 3.6.
【解析】
通过图像可知,甲池为原电池,且通入氧气的一极为正极,通入甲醇的一极为负极,则A为阴极,Fe不参与反应,B为阳极。
(1)充电时:作电解池,①燃料电池的正极产生氧气,化合价由-2变为0,失电子,则与电源的正极相连;
②燃料电池的正极作电解池的阳极,氢氧根离子失电子生成氧气,电极反应式为4OH--4e-=2H2O+O2↑;
(2)放电时:甲烷失电子与溶液中的氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-=CO32-+6H2O;
(3)乙池为电解池,A极作阴极,Ag++e-=Ag,质量增加324g,即0.3mol,理论上生成0.75mol氧气,即标况下的16.8L;
(4)氢气与二氧化碳生成甲醇和水,方程式为3H2(g)+CO2(g)=H2O(g)+CH3OH(g),3g氢气完全反应释放24.5kJ的热量,则6g即3mol氢气释放49.0kJ,焓变为-49.0kJ·mol-1;
(5)消耗甲醇1.6g即0.05mol时,转移0.3mol电子,则生成0.15molMg,即3.6g。