题目内容
【题目】铜铁及其化合物在日常生活和工业生产中有着重要用途。
(1)铁制炊具在潮湿的空气中易发生吸氧腐蚀而生锈,负极的电极反应式为:___,正极的电极反应式为:___。
(2)下列哪些装置可防止铁棒被腐蚀___。(填正确答案标号)
A.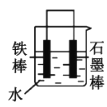 B.
B.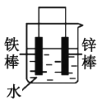 C.
C.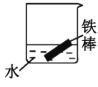 D.
D.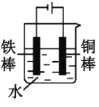
(3)高铁酸钾(K2FeO4)广泛应用于净水、电池工业等领域。工业上以钛白粉生产的副产品FeSO4制备高铁酸钾的生产流程如图:
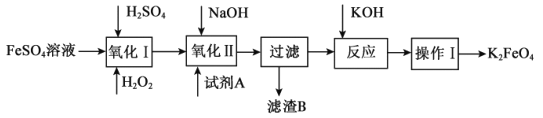
查阅资料:K2FeO4在水中溶解度很大,在碱性环境中稳定,在中性和酸性条件下不稳定。
①“氧化I”中,生成Fe3+的离子反应方程式是___。
②净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,请补充并配平该反应方程式: K2FeO4+ H2O= Fe(OH)3↓+ KOH+ 。___。
(4)工业上常以铜做阳极,石墨做阴极,电解含有NaOH的NaCl水溶液制备Cu2O。
已知:该电解过程中阳极先生成难溶物CuCl,再与NaOH反应转化为Cu2O。
①写出阳极的电极反应式___,该过程中生成Cu2O的离子反应方程式为___。
②如果电解后溶液体积未发生变化,电解后溶液中的c(OH-)会___(填“变大”“变小”或“不变”)。
③若电解时电路中通过0.2mol电子,理论上生成Cu2O的质量为___g。
【答案】Fe-2e-=Fe2+ O2+4e-+2H2O=4OH- BD H2O2+2H++2Fe2+=2Fe3++2H2O 4K2FeO4+10H2O=4Fe(OH)3↓+8KOH+3O2↑ Cu+Cl--e-=CuCl 2CuCl+2OH-=Cu2O+2Cl-+H2O 不变 14.4
【解析】
(1)铁制品是铁合金,在潮湿的空气中易发生吸氧腐蚀而生锈,铁作负极被氧化,正极上是氧气得电子被还原;
(2)铁为活泼金属,易发生电化学腐蚀;若铁为原电池的正极,比铁活泼的金属作负极,可防止铁被腐蚀;若铁为外接电源的负极,为外加电流的阴极保护法,可防止铁被腐蚀;
(3)以钛白粉生产的副产品FeSO4制备高铁酸钾,由制备流程可知,I中亚铁离子与过氧化氢发生氧化还原反应生成铁离子,II中发生3NaClO+Fe2(SO4)3+10NaOH=2Na2FeO4↓+3NaCl+3Na2SO4+5H2O,过滤分离出NaCl、Na2SO4,再加KOH发生Na2FeO4+2KOH=K2FeO4+2NaOH,操作I中包括冷却结晶,过滤洗涤、干燥几个步骤,洗涤选择乙醇,防止高铁酸钾溶解而损失,以此来解答;
(4)①电解池中阳极发生氧化反应,铜失去1个电子与氯离子结合生成氯化亚铜沉淀,据此写出阳极反应方程式;氯化亚铜与氢氧化钠反应生成氧化亚铜、氯化钠和水;
②根据阴极、阳极的反应式分析;
③电解电路中通过0.2mol电子,理论上生成Cu2O也为0.2mol,再计算质量。
(1)铁制品是铁合金,在潮湿的空气中易发生吸氧腐蚀而生锈,铁作负极被氧化,正极上是氧气得电子被还原,则负极的电极反应式为:Fe-2e-=Fe2+,正极的电极反应式为:O2+4e-+2H2O=4OH-;
(2)A.图中铁碳形成原电池反应,铁为负极,碳为正极,为铁的吸氧腐蚀,故A不符合题意;
B.锌比铁活泼,铁为正极,被保护而难以腐蚀,故B符合题意;
C.水中溶解氧气,铁可发生电化学腐蚀,正极反应式:O2+2H2O+4e-=4OH-,负极反应式:Fe-2e-=Fe2+,故C不符合题意;
D.电解池中铁棒是阴极,铜棒是阳极,铁棒得到了保护,故D符合题意;
答案选BD;
(3)①氧化Ⅰ中,生成Fe3+的离子反应方程式为H2O2+2H++2Fe2+=2Fe3++2H2O;
②净水时高铁酸钾能逐渐与水反应生成絮状的Fe(OH)3,由电子、电荷守恒可知反应的方程式为4K2FeO4+10H2O=4Fe(OH)3↓+8KOH+3O2↑;
(4)①铜作阳极,石墨作阴极,在含有NaOH的NaCl水溶液中电解,在阳极生成难溶CuCl,再与NaOH反应转化为Cu2O,阳极电极反应式为:Cu+Cl--e-=CuCl;氯化亚铜与氢氧化钠反应生成氧化亚铜、氯化钠和水,离子反应为:2CuCl+2OH-=Cu2O+2Cl-+H2O;
②阳极电极反应式为:2Cu+2Cl--2e-=2CuCl;阴极反应式为:2H2O+2e=H2↑+2OH,2CuCl+2OH-=Cu2O+2Cl-+H2O,转移电子数相等,则产生和消耗的OH物质的量相等,则电解后溶液中c(OH)不变;
③若电解电路中通过0.2mol电子,根据Cu+Cl--e-=CuCl,生成0.2mol CuCl,根据2CuCl+2OH-=Cu2O+2Cl-+H2O,理论上生成Cu2O的物质的量为0.1mol,则质量为0.1mol×144g/mol=14.4g。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案