题目内容
【题目】已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH ![]() CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸 ④加水
A. ①② B. ②④ C. ③④ D. ①③
【答案】B
【解析】①加少量烧碱溶液,![]() ,加少量烧碱溶液,溶液的酸性减弱,使醋酸的电离平衡正向移动,c(CH3COO-)增大,
,加少量烧碱溶液,溶液的酸性减弱,使醋酸的电离平衡正向移动,c(CH3COO-)增大,![]() 值减小,故①错误;②弱电解质的电离过程是吸热的,升高温度促进电离,溶液中c(H+)增大,c(CH3COOH)降低,
值减小,故①错误;②弱电解质的电离过程是吸热的,升高温度促进电离,溶液中c(H+)增大,c(CH3COOH)降低,![]() 值增大,故②正确;③
值增大,故②正确;③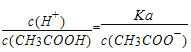 加少量冰醋酸,使醋酸的电离平衡正向移动,c(CH3COO-)增大,
加少量冰醋酸,使醋酸的电离平衡正向移动,c(CH3COO-)增大,![]() 值减小,故③错误;④
值减小,故③错误;④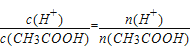 ,加水促进电离,溶液中n(H+)增大,n(CH3COOH)降低,
,加水促进电离,溶液中n(H+)增大,n(CH3COOH)降低,![]() 值增大,故④正确;故选C。
值增大,故④正确;故选C。

【题目】Ⅰ.某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+.为了减少污染变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案.

(1)A是______B是_______
(2)操作Ⅱ是_____操作Ⅲ是______。
Ⅱ.松花蛋于明朝初年问世,其腌制配方有多种,但主要配料为生石灰、纯碱和食盐。将一定比例的配料用水和黏土调成糊状,敷于蛋上,密封保存,数日后可食用。
(1)腌制松花蛋的配料用水调制时,主要发生的化学反应的方程式有(不考虑黏土中物质可能参与的反应)___________________、_____________________。
(2)松花蛋外的糊状物经溶解、过滤后,滤液中肯定含有的溶质为________和_______,可能含有的溶质为Ca(OH)2或Na2CO3。
(3)某同学设计下表的实验方案,探究(2)所得滤液中可能含有的物质是否存在,请你帮他完善实验方案。
实验步骤 | 实验现象 | 实验结论 |
①取少量滤液,滴加适量K2CO3溶液 | 若出现白色沉淀 | 滤液中含Ca(OH)2 |
若无白色沉淀 | 滤液中无Ca(OH)2 | |
②取少量滤液,________ | 若出现________ | 滤液中含Na2CO3 |

