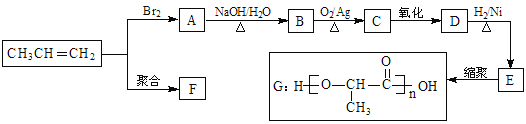
题目内容
【题目】I.工业上可由氢气、氮气合成氨气,溶于水形成氨水。盐酸和氨水是实验室常见的电解质溶液。一定温度下,向2L 密闭容器中加入N2(g) 和H2(g),发生反应:N2(g)+3H2(g)2NH3(g) △H=—Q kJ/mol(Q>0),NH3物质的量随时间的变化如图所示。

(1)0到2 min 内的平均反应速率 v(H2)=________。
(2)该温度下,反应 N2(g)+3H2(g)![]() 2NH3(g) △H = —Q kJ/mol(Q>0)的平衡常数表达式K=________________。其平衡常数K与温度T的关系如下表:
2NH3(g) △H = —Q kJ/mol(Q>0)的平衡常数表达式K=________________。其平衡常数K与温度T的关系如下表:
T/ ℃ | 25 | 125 | 225 |
平衡常数 K | 4×106 | K1 | K2 |
试判断K1_______K2(填写“>”“=”或“<”)。
(3)若反应是在固定体积的密闭容器中进行,下列能说明合成氨反应已达到平衡状态的是___(填字母)
A.3v(N2) = v(H2)
B.容器内压强保持不变
C.混合气体的密度保持不变
D.25℃时,测得容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
【答案】0.375 mol/(L·min) ![]() > BD
> BD
【解析】
根据图像和反应速率比等于化学计量数比这一规律计算化学反应速率;根据化学平衡移动的方向确定化学平衡常数大小;根据体系中各物质含量的发生变化情况判断反应是否达平衡状态。
(1)根据图像,2min时氨气生成1.0mol,则2min内氨气的平均反应速率v(NH3)=![]() =
= =0.25mol·L-1·min-1,根据化学反应中反应速率比等于化学计量数比这一规律,可以得出v(H2)=
=0.25mol·L-1·min-1,根据化学反应中反应速率比等于化学计量数比这一规律,可以得出v(H2)=![]() v(NH3)=0.375 mol·L-1·min-1;
v(NH3)=0.375 mol·L-1·min-1;
(2)根据化学平衡常数定义确定化学平衡常数表达式,即K=![]() ;由于该反应为放热反应,升高温度平衡向吸热反应方向移动,即逆反应方向,则升高温度的过程中生成物浓度减小反应物浓度增加,化学平衡常数减小,则K1>K2;
;由于该反应为放热反应,升高温度平衡向吸热反应方向移动,即逆反应方向,则升高温度的过程中生成物浓度减小反应物浓度增加,化学平衡常数减小,则K1>K2;
(3)A选项,没有明确氮气和氢气是否为反应速率或生成速率,若均为反应速率则反应是否达平衡,氮气与氢气的反应速率比均为1:3,A错误;
B选项,反应是一个气体体积不断减小的反应,当反应达平衡时,各组分的百分含量不再发生变化,容器内压强不再发生变化,可以判断反应达平衡状态,B正确;
C选项,根据质量守恒定律,容器内气体总质量不变,由于该反应在一个恒容的容器中进行,气体的体积不变,故混合气体的密度恒不变,不能判断反应达平衡状态,C错误;
D选项,25℃时反应的平衡常数K=![]() =
=![]() =4×106,与题(2)中25℃时的平衡常数相同,可以判断反应达平衡,D正确;
=4×106,与题(2)中25℃时的平衡常数相同,可以判断反应达平衡,D正确;
故选择BD。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】某小组在实验室中探究金属钠与二氧化碳的反应。回答下列问题:

(1)选用如图所示装置及药品制取CO2。打开弹簧夹,制取CO2。为了得到干燥.纯净的CO2,产生的气流应依次通过盛有_________的洗气瓶(填试剂名称)。反应结束后,关闭弹簧夹,可观察到的现象是____________________________。不能用稀硫酸代替稀盐酸,其原因是______________________________。
(2)金属钠与二氧化碳反应的实验步骤及现象如下表:
步骤 | 现象 |
将一小块金属钠在燃烧匙中点燃,迅速伸入盛有CO2的集气瓶中。充分反应,放置冷却 | 产生大量白烟,集气瓶底部有黑色固体产生,瓶壁上有白色物质产生 |
在集气瓶中加入适量蒸馏水,振荡.过滤 | 滤纸上留下黑色固体,滤液为无色溶液 |
①为检验集气瓶瓶壁上白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红:向第二支试管中滴加澄清石灰水,溶液变浑浊。
据此推断,白色物质的主要成分是________(填标号)。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
②为检验黑色固体的成分,将其与浓硫酸反应,生成的气体具有刺激性气味。据此推断黑色固体是________________。
③本实验中金属钠与二氧化碳反应的化学方程式为_______________________。