题目内容
铝广泛应用于化学工业和日常生活中。工业上由铝土矿(Al2O3?3H2O的含量约为85%,其余主要为SiO2、Fe2O3等)冶炼金属铝的流程如下。
已知拜耳法生产Al2O3?3H2O的基本原理为:
Al2O3?3H2O+2NaOH(aq) 2NaAlO2(aq)+4H2O,[Al2O3?3H2O也可表示为2 Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3?3H2O也可表示为2 Al(OH)3]
(1)操作I的名称为 ,赤泥中除含有铝硅酸盐外,还含有的主要物质有 。
(2)为了提高铝土矿的溶出速率可采取的有效措施为
(任写三点)。
(3)用化学平衡理论解释稀释溶液I有利于Al2O3?3H2O 结晶的原因____________ 。
(4)为了析出Al2O3?3H2O,也可向溶液I中通入过量CO2气体,写出生成Al2O3?3H2O的离子方程式: 。
(5)为了回收赤泥附着液带走的有用成分,工业上将用热水洗涤后的洗液用作溶液I的稀释剂,请指出流程图中另一处类似的做法 。
(16分)
(1)过滤 Fe2O3 (共4分,各2分)
(2)将铝土矿粉碎、加热、搅拌、增大NaOH的浓度(任答三点即得满分)(3分)
(3)稀释降低了NaOH的浓度,有利于NaAlO2或NaAl(OH)4的水解,使平衡向结晶方向移动(或向左移动)(3分)
(4)CO2(过量)+ AlO2-+2H2O = Al(OH)3↓+HCO3- 或
2CO2(过量)+ 2AlO2-+4H2O = Al2O3?3H2O↓+2HCO3- (3分)
写下列反应也得分:
CO2(过量)+[Al(OH) 4]-= Al(OH)3↓+HCO3- 或
2CO2(过量)+2[Al(OH) 4]-= Al2O3?3H2O↓+2HCO3- (3分)
(5)将溶液III循环使用溶解铝土矿 (3分)
解析试题分析:(1)铝土矿中Al2O3?3H2O、SiO2都能溶于过量NaOH溶液中,而Fe2O3是碱性氧化物,不溶于NaOH溶液,过滤是分离固液混合物的常用方法,则操作I为过滤;赤泥中除含有铝硅酸盐外,还含有氧化铁;溶液I的主要成分是偏铝酸钠、硅酸钠、氢氧化钠;(2)根据外界条件对化学反应速率的影响规律,将铝土矿粉碎、加热、搅拌、增大NaOH的浓度等,都能提高铝土矿的浸出速率和浸出率;(3)溶液I中存在如下平衡:Al2O3?3H2O(s)+2NaOH(aq) 2NaAlO2(aq)+4H2O(l),稀释不仅能减小氢氧化钠的浓度,还能促进NaAlO2的水解,使平衡左移,析出Al2O3?3H2O(s);(4)碳酸是弱酸,氢氧化铝是两性氢氧化物,则酸性:H2CO3>Al(OH)3,碳酸盐与过量二氧化碳、水能反应生成碳酸氢盐,则溶液I中通入过量二氧化碳气体的反应为CO2(过量)+ AlO2-+2H2O = Al(OH)3↓+HCO3-或2CO2(过量)+ 2AlO2-+4H2O = Al2O3?3H2O↓+2HCO3-、CO2(过量)+[Al(OH)4]-= Al(OH)3↓+HCO3- 、2CO2(过量)+2[Al(OH) 4]-= Al2O3?3H2O↓+2HCO3-;(5)依题意可知,工业上常采取循环利用的方法,降低能耗、成本,提高生产效率,可以将该化学工艺流程图中溶液III中的NaOH溶液循环使用,用于溶解铝土矿。
2NaAlO2(aq)+4H2O(l),稀释不仅能减小氢氧化钠的浓度,还能促进NaAlO2的水解,使平衡左移,析出Al2O3?3H2O(s);(4)碳酸是弱酸,氢氧化铝是两性氢氧化物,则酸性:H2CO3>Al(OH)3,碳酸盐与过量二氧化碳、水能反应生成碳酸氢盐,则溶液I中通入过量二氧化碳气体的反应为CO2(过量)+ AlO2-+2H2O = Al(OH)3↓+HCO3-或2CO2(过量)+ 2AlO2-+4H2O = Al2O3?3H2O↓+2HCO3-、CO2(过量)+[Al(OH)4]-= Al(OH)3↓+HCO3- 、2CO2(过量)+2[Al(OH) 4]-= Al2O3?3H2O↓+2HCO3-;(5)依题意可知,工业上常采取循环利用的方法,降低能耗、成本,提高生产效率,可以将该化学工艺流程图中溶液III中的NaOH溶液循环使用,用于溶解铝土矿。
考点:考查有关物质制备的化学工艺流程大题,涉及解释粉碎固体原料的原因、判断还原剂、根据盖斯定律计算焓变、解释惰性气体的作用、燃料电池的工作原理、正极反应式、溶液pH变化情况等。

氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是
| A.HI和HClO | B.HCl和HIO |
| C.HClO3和HIO | D.HClO和HIO |
如图装置可用于收集SO2并验证其某些化学性质,下列说法正确的是 ( )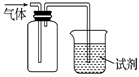
| 选项 | 试剂 | 现象 | 结 论 |
| A | 酸性KMnO4溶液 | 溶液褪色 | SO2有氧化性 |
| B | 品红溶液 | 溶液褪色 | SO2有漂白性 |
| C | NaOH溶液 | 无明显现象 | SO2与NaOH 溶液不反应 |
| D | 紫色石蕊试液 | 溶液变红色后不褪色 | SO2有酸性,没有漂白性 |

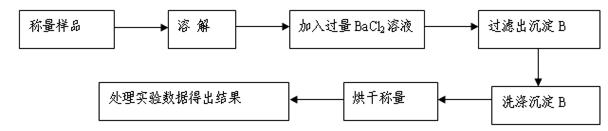

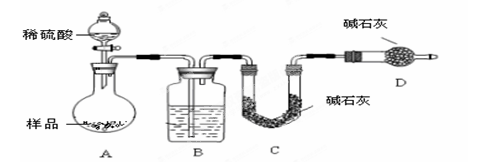

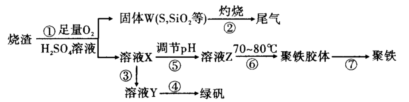

 2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。
2Al2O3+9SO2,该反应的氧化剂是_______。若生成l molAl2O3,则转移的电子数为__________________。