题目内容
某校研究性学习小组的同学进行了以下化学实验:将金属钙置于空气中燃烧,然后向所得固体产物中加入一定量蒸馏水,此过程中反应放出大量的热,并且放出有臭味的气体。
(1)甲同学提出:运用类比学习的思想,Ca与Mg是同一主族元素,化学性质具有一定的相似性。
请写出Ca在空气中燃烧发生反应的化学方程式: 。
(2)乙同学提出:Ca的性质比Na活泼,在空气中燃烧还应有CaO2生成,请写出燃烧后固体产物与水反应放出气体的化学方程式: 。
丙同学提出用实验的方法探究放出臭味气体的成份:
【查阅资料】1:CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3
2:碘量法是最常用的臭氧测定方法:其原理为强氧化剂臭氧(O3)与碘化钾(KI)水溶液反应生成游离碘(I2)。臭氧还原为氧气。反应式为:O3+2KI+H2O=O2+I2+2KOH 【提出假设】假设1:该臭味气体只有NH3;
假设2:该臭味气体只有 ;
假设3:该臭味气体含有 。
【设计方案进行实验探究】
(3)基于假设l,该小同学组设计如下实验方案,并进行实验。请在答题卡上按下表格式完成相关的实验操作步骤、预期现象及结论(仪器自选)。
【限选实验试剂】:红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉一KI溶液、蒸馏水。设计实验方案证明你的假设,并按下表格式写出实验操作步骤、预期现象和结论。
| 实验操作 | 预期现象和结论 |
| 取少量反应后固体于试管中, 。 | |
(1)Ca+O2=CaO2(1分)3Ca+N2=Ca3 N2(1分)2Ca+CO2=2CaO+C (1分);
(2)2CaO2+2H2O=2Ca(OH)2 +O2↑(2分)Ca3N2+6H2O=3Ca(OH)2+2NH3↑(2分);
(3)假设2:该臭味气体只有O 3(1分);
假设3:该臭味气体含有O 3和NH3(1分);实 验 操 作 预 期 现 象 与 结 论 取少量反应后固体于试管中,向试管中加入少量水,将湿润的红色石蕊试纸置于试管口;
另取少量反应后固体于试管中,向试管中加入少量水,将产生气体通入淀粉—KI溶液中; (2分) 若红色石蕊试纸显蓝色,且淀粉—KI溶液不变色 则假设1成立;
若 红色石蕊试纸不显蓝色,且淀粉—KI溶液变蓝色, 则假设2成立;
若红色石蕊试纸显蓝色,且淀粉—KI溶液变蓝色,则假设3成立;(3分)
解析试题分析:(1)Mg在空气中燃烧,可与O2、N2、CO2反应,所以Ca也能与O2、N2、CO2反应,进而写出化学方程式。
(2)CaO2类比Na2O2,写出CaO2与H2O的化学方程式:2CaO2+2H2O=2Ca(OH)2 +O2↑;Ca3N2与H2O发生水解反应,生成Ca(OH)2与NH3:Ca3N2+6H2O=3Ca(OH)2+2NH3↑。
(3)根据题目所给信息:CaO2遇水反应生成H2O2,H2O2可能会分解产生一定量的O3,可推出假设2为:该臭味气体只有O 3,假设3为:该臭味气体含有O 3和NH3;根据NH3溶于水显碱性,可用湿润的红色湿润试纸检验是否含NH3,利用O3具有强氧化性,可用淀粉-KI溶液检验是否含O3。
考点:本题考查化学方程式的书写、实验方案的设计与分析。

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案小明很喜欢化学实验课,今天要学习“探究铁及其化合物的氧化性或还原性”,现邀你一起走进他的化学课堂。
(1)课前老师布置了下列预习作业,请你一起完成:
①铁不同价态的物质各写一种(并标出铁元素的化合价):_____、_______、 ________。
②写出一个它们之间相互转化(含三种价态)的化学方程式:___________________ 。
(2)实验室提供的下列试剂:锌粒、铁粉、0.1 mol·L-1 FeCl3溶液、0.1 mol·L-1 FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性。
根据氧化还原反应的有关原理,小明说Fe2+既有还原性又有氧化性,为证实自己的假设,请你和小明一起设计实验方案,进行实验并描述实验现象,完成下列表格。
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe2+具有还原性 | 取少量0.1 mol·L-1 FeCl2溶液,加入足量__________后,再往溶液中加入少量__________ | 溶液变成血红色 |
| 探究Fe2+具有氧化性 | 取少量0.1 mol·L-1 FeCl2溶 液,加入_________充分 反应 | 溶液由浅绿色变无色 所发生反应离子方程式为________________ [来源:Z|xx|k.Com] |
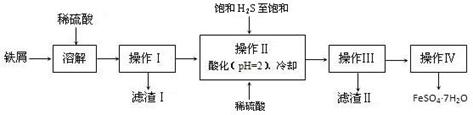
FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
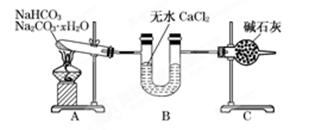
I、经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水 FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下: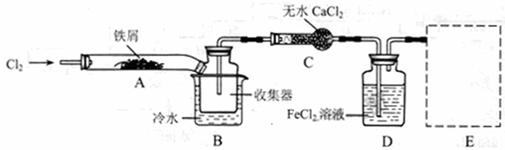
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(4)如果没有装置C的设计,会导致 。
(5)用离子方程式表示虚线框E中所增加装置和试剂的作用: 。
(6)用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,
请写出反应的离子方程式: 。
Ⅱ、反应结束后,将收集器中所得固体完全溶于稀盐酸,小组同学对所得溶液金属阳离子的成分有三种观点:①只有Fe3+;②只有Fe2+;③ 。
为探究溶液的组成,实验如下:
| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液。 | | 说明:假设②不成立,假设①或③成立;的离子方程式是 。 |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液。 | 溶液紫红色退去 | 说明: 。 |
综合上述实验分析,所得溶液中含有的金属阳离子有 。



 2NaAlO2(aq)+4H2O,[Al2O3?3H2O也可表示为2 Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3?3H2O也可表示为2 Al(OH)3]