题目内容
氯化碘(ICl)的化学性质跟氯气相似,预计它跟水反应的最初生成物是
| A.HI和HClO | B.HCl和HIO |
| C.HClO3和HIO | D.HClO和HIO |
B
解析试题分析: 氯气和水反应的方程式:Cl2 + H2O ="===" HClO + HCl , 氯气分子中,一个氯原子的化合价升高(次氯酸中),另一个氯原子的化合价降低(盐酸中)。然后在氯化碘中,因为氯原子的非金属性(氧化性)> 碘原子,可以推知碘呈现+1价而氯-1价,故答案选B
考点:考查卤族元素氯和碘氧化性强弱比较的相关知识点。

 阅读快车系列答案
阅读快车系列答案FeCl3在现代工业生产中应用广泛。某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
I、经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华。他们设计了制备无水 FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下: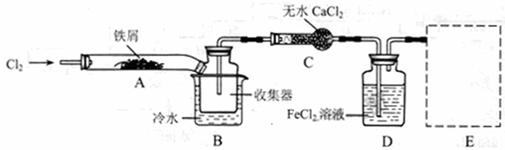
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④……
⑤体系冷却后,停止通入Cl2,并用干燥的H2赶尽Cl2,将收集器密封。
请回答下列问题:
(1)装置A中反应的化学方程式为 。
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端。要使沉积的FeCl3进入收集器,第④步操作是 。
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) 。
(4)如果没有装置C的设计,会导致 。
(5)用离子方程式表示虚线框E中所增加装置和试剂的作用: 。
(6)用装置D中的副产品FeCl3溶液吸收H2S,得到单质硫,
请写出反应的离子方程式: 。
Ⅱ、反应结束后,将收集器中所得固体完全溶于稀盐酸,小组同学对所得溶液金属阳离子的成分有三种观点:①只有Fe3+;②只有Fe2+;③ 。
为探究溶液的组成,实验如下:
| 实验步骤 | 实验现象 | 实验结论及反应离子方程式 |
| ①取少量所得溶液于试管中,加入少量KSCN溶液。 | | 说明:假设②不成立,假设①或③成立;的离子方程式是 。 |
| ②另取少量所得溶液于试管中,加入少量酸性 KMnO4溶液。 | 溶液紫红色退去 | 说明: 。 |
综合上述实验分析,所得溶液中含有的金属阳离子有 。
在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。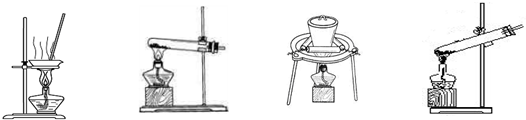
A B C D
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察 | 现象:溶液中产生大量白色沉淀; 结论: 。 |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察 | 现象: ; 结论:样品中含有NaHCO3。 |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察 | 现象: ; 结论: 。 |
(4)用碘量法测量自来水中残留的Cl2的浓度:
① 在大锥形瓶中放置过量的KI,加一定量的冰醋酸,准确取水样200mL加入瓶中,迅速塞上瓶塞摇动,水样呈淡黄色,发生反应:Cl2+2I-=2Cl-+ I2。
②加少许淀粉溶液,用cmol/L Na2S2O3溶液滴定,发生反应:I2+2S2O32-=2I-+S4O62-,当 ,达到滴定终点。
③重复操作3次,平均读数为V mL,则该样品中残留Cl2的浓度: mg/L(Cl的相对原子质量:35.5)
如图,在注射器中加入少量Na2SO3晶体,并吸入少量浓硫酸(以不接触纸条为准)。则下列有关说法正确的是( ) 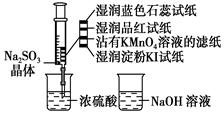
| A.蓝色石蕊试纸先变红后褪色 |
| B.品红试纸、沾有KMnO4溶液滤纸均褪色都能证明SO2的漂白性 |
| C.湿润淀粉KI试纸未变蓝说明SO2的氧化性弱于I2 |
| D.NaOH溶液和品红溶液均可用于除去实验中多余的SO2 |
把100mL 2mol/L的H2SO4跟过量锌粉反应,在一定温度下,为了减缓反应速率而不影响生成H2的总量,可在反应物中加入适量的
| A.硫酸铜溶液 | B.硝酸钠溶液 | C.醋酸钠溶液 | D.氢氧化钠溶液 |
向硝酸钠溶液中加入铜粉不发生反应,若再加入(或通入)某种物质,则铜粉可以逐渐溶解,不符合此条件的物质是
| A.Fe(NO3)3 | B.HCl | C.NaHSO4 | D.NaHCO3 |
已知氨气可与灼热的氧化铜反应得到氮气和金属铜,用下图中的装置可以实现该反应。实验时C中粉末逐渐变为红色,D中出现无色液体。下列有关说法正确的是 ( )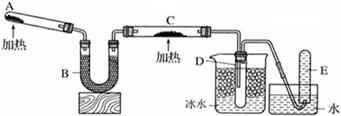
| A.反应中氧化剂和还原剂的物质的量之比为2∶3 |
| B.装置B中加入的物质可以是碱石灰或无水氯化钙 |
| C.装置D中液体可以使干燥的红色石蕊试纸变蓝 |
| D.为防止装置D中发生倒吸,可以改用向下排空气法收集氮气 |
下列叙述不正确的是
| A.NH3易液化,液氨常用作制冷剂 |
| B.与铜反应时,浓硝酸被还原成NO2而稀HNO3被还原成NO,所以稀HNO3氧化性强于浓HNO3 |
| C.氨盐受热易分解,因此贮存氨态氮肥时要密封保存,并放在阴凉通风处 |
| D.氨水逐滴滴加到硝酸银溶液中,先出现沉淀,后沉淀溶解 |

 2NaAlO2(aq)+4H2O,[Al2O3?3H2O也可表示为2 Al(OH)3]
2NaAlO2(aq)+4H2O,[Al2O3?3H2O也可表示为2 Al(OH)3]